
【题目】我国拥有丰富的稀土矿产资源,在合金中加入适量的稀土金属,能大大改善合金的性能,因而,稀土金属又被称为冶金工业的维生素。铈是一种重要的稀土元素,常见的化合价为+3和+4。某课题小组以平板电视显示屏生产过程中,产生的大量废玻璃粉末为原料(其中含有SiO2、Fe2O3、CeO2、FeO等物质),制取CeO2和硫酸铁铵矾[NH4Fe(SO4)212H2O],流程如下:
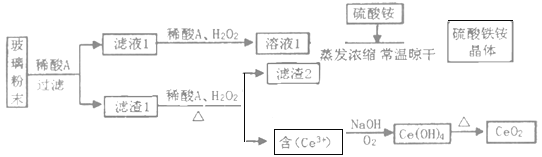
已知:CeO2不溶于强酸或强碱
(1)稀酸A中酸的分子式是___。滤渣2的主要成分___。(填化学式)
(2)滤液1中加入H2O2溶液的目的是___。滤渣1中加入H2O2,主要利用了H2O2的什么性质?___。
(3)酸性条件下,H2O2、Fe3+、CeO2三种物质,氧化性由强到弱的顺序是___。
(4)写出由滤液2生成Ce(OH)4的离子方程式___。
(5)硫酸铁铵矾[NH4Fe(SO4)212H2O]广泛用于水的净化处理,其净水原理是___(用离子方程式表示)。
(6)取上述流程中所获得的Ce(OH)4样品5.31g,加稀H2SO4溶解后配制成100mL溶液,取出10.00mL,用浓度为0.1000 molL-1FeSO4标准溶液滴定至终点时(铈被还原为Ce3+),消耗25.00mL标准溶液。该样品中Ce(OH)4的纯度是___。
【答案】H2SO4 SiO2 Fe2+氧化为Fe3+ 还原性 CeO2> H2O2> Fe3+ 4Ce3++O2+12OH-+2H2O═4Ce(OH)4↓ Fe3++3H2OFe(OH)3(胶体)+3H+ ![]() %
%
【解析】
反应过程为:废玻璃粉末(含SiO2、Fe2O3、CeO2、FeO等物质)中加入稀硫酸,FeO转化为FeSO4、Fe2O3转化Fe2(SO4)3存在于滤液1中,滤渣1为CeO2和SiO2;滤液1中加入稀硫酸和过氧化氢,被FeSO4氧化为Fe2(SO4)3,溶液1为Fe2(SO4)3溶液,加入硫酸铵混合蒸发浓缩、常温晾干后得到硫酸铁铵晶体;滤渣1中加入稀硫酸和H2O2,CeO2转化为Ce3+存在于滤液2中,反应为2CeO2+H2O2+3H2SO4=Ce2(SO4)3+O2↑+4H2O,滤渣2为SiO2;滤液2加入NaOH并通入氧气将Ce从+3氧化为+4后Ce3+转化为沉淀Ce(OH)4,反应为:4Ce3++O2+12OH-+2H2O═4Ce(OH)4↓,加热分解Ce(OH)4得到产品CeO2。
(1)已知:CeO2不溶于强酸强碱,废玻璃粉末(含SiO2、Fe2O3、CeO2、FeO等物质)中SiO2也不溶于强酸,加入稀硫酸可将CeO2和SiO2与Fe2O3、FeO分离,稀酸为H2SO4;滤渣2为SiO2;
(2)滤液1中加入H2O2溶液的目的是使Fe2+氧化为Fe3+;滤渣1中加入H2O2,主要利用了H2O2的还原性;
(3)酸性环境下,2CeO2+H2O2+6H+=2Ce3++O2↑+4H2O,CeO2中Ce元素化合价从+4变为+3,化合价降低,被还原,发生还原反应,CeO2作氧化剂,其氧化性:CeO2> H2O2,2Fe2++H2O2+2H+=2Fe3++2H2O,H2O2中O元素的化合价从-1变为-2,化合价降低,被还原,发生还原反应,H2O2作氧化剂,其氧化性:H2O2> Fe3+,所以氧化性:CeO2> H2O2> Fe3+;
(4)液2加入NaOH并通入氧气将Ce从+3氧化为+4后Ce3+转化为沉淀Ce(OH)4,滤液2生成Ce(OH)4的离子方程式为:4Ce3++O2+12OH-+2H2O═4Ce(OH)4↓
(5)硫酸铁铵矾[NH4Fe(SO4)212H2O]广泛用于水的净化处理,Fe3+的水解生成具有吸附作用的Fe(OH)3胶体,其离子方程式为:Fe3++3H2OFe(OH)3(胶体)+3H+
(6)Ce(OH)4 ~ FeSO4
0.0025mol 0.1000mol/L-1×0.025L
所以m(Ce(OH)4 )= 0.025mol×208g/mol = 5.2g,
产品中Ce(OH)4的质量分数为:![]() %。
%。


科目:高中化学 来源: 题型:
【题目】现将1.92gCu投入到一定量的浓HNO3中,Cu完全溶解,生成气体颜色越来越浅,共收集到标准状况下672mL的NOX混合气体,将盛有此气体的容器倒扣在水槽中,通入标准状况下一定体积的O2,恰好使气体完全溶于水,则通入标准状况下的O2的体积为( )
A. 504mLB. 336mLC. 224mLD. 168mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)分别写出由氧在一定条件下生成下列物质的化学方程式(必须注明反应条件)。
①Na2O2_______________。
②Na2O__________________。
(2)KO2能吸收CO2生成K2CO3和O2,故可用作特殊情况下的氧气源,试写出该反应的化学方程式:_____________________。
(3)活泼金属复杂的氧化物(如过氧化物、超氧化物等)在一定条件下都可以生成氧气,从而用作特殊情况下的氧气源。现有下列四种物质,你认为在运输鱼苗的时候用(________)作为氧气源更合适?理由是:_________ 。
A.Na2O2 B.K2O2 C.KO2 D.CaO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W为四种常见元素,其中X、Y、Z为短周期元素。有关信息如表所示.
原子或分子相关信息 | 单质或化合物相关信息 | |
X |
| X的最高价氧化物对应的水化物为无机酸中的最强酸 |
Y | Y原子的最外层电子数等于电子层数 | Y的氧化物是典型的两性氧化物,可用于制造一种极有前途的高温材料 |
Z | Z原子的最外层电子数是次外层电子数的 | Z是无机非金属材料的主角,其单质是制取大规模集成电路的主要原料 |
W | W原子的最外层电子数小于4 | W的常见化合价有 |
(1)W在周期表中的位置为______,![]() 在空气中不稳定,极易被氧化,由白色迅速变成灰绿色,最后变成红褐色,反应的化学方程式为______
在空气中不稳定,极易被氧化,由白色迅速变成灰绿色,最后变成红褐色,反应的化学方程式为______
(2)X的简单阴离子的结构示意图为______,X的最高价氧化物对应水化物的水溶液与Y的氧化物反应的离子方程式为________
(3)Z的氧化物在通讯领域用来作______,工业上制备Z的单质的化学反应方程式为______。锗与Z是同一主族元素,它可用来制造半导体品体管.研究表明:有机锗具有明显的抗肿瘤活性,锗不与![]() 溶液反应但在有
溶液反应但在有![]() 存在时可与
存在时可与![]() 溶液反应生成锗酸盐,反应的化学方程式为_______
溶液反应生成锗酸盐,反应的化学方程式为_______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝是应用广泛的金属,以铝土矿(主要成分为A12O3,含SiO2和Fe2O3等杂质)为原料制备铝的一种工艺流程如图:

已知:SiO2在“碱溶”时转化为铝硅酸钠沉淀。
(1)“碱溶”时生成偏铝酸钠的离子方程式为__。
(2)“滤渣Ⅰ”的成分有___。
(3)向“过滤Ⅰ”所得滤液中通入足量的CO2,反应的离子方程式为___。
(4)“滤液Ⅱ”中加入足量的CaO,生成的__(填化学式)可循环利用。
(5)“灼烧”的化学方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化铁的用途较为广泛。工业上用废铁屑制备氧化铁的流程如图:
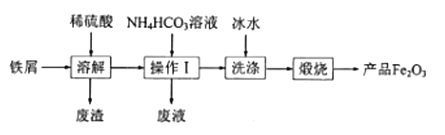
(1)“溶解”时主要反应的离子方程式为___。
(2)操作Ⅰ的名称是___。
(3)加入 NH4HCO3溶液生成FeCO3沉淀和CO2,则“废液”中含有的主要离子有___。
(4)在空气中煅烧FeCO3可得产品Fe2O3,写出该反应的化学方程式:___。实际生产时,产品Fe2O3中常混有FeO。为了减少FeO,“煅烧”时可以采取的措施有___(写一条)。
(5)产品Fe2O3与A粉的混合物称为铝热剂,可用于焊接铁轨。该反应的化学方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有X、Y、Z三种短周期元素,其原子半径的大小顺序为X>Y>Z,原子序数之和为16。三种元素的常见单质在适当条件下可发生如图所示的反应,其中A为X、Y组成的双原子分子,B和C均为10电子分子。下列判断错误的是( )
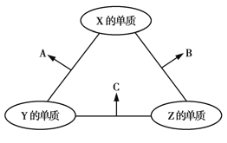
A.X的最外层电子数为6
B.A和C之间不可能发生氧化还原反应
C.B的沸点高于C的沸点
D.A不能溶于B中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期金属元素甲~戊在元素周期表中的相对位置如右表所示,下面判断正确的是
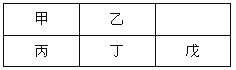
A. 原子半径:丙<丁<戊B. 金属性:甲>丙
C. 氢氧化物碱性:丙>丁>戊D. 最外层电子数:甲>乙
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com