
【题目】R、W、X、Y、M是原子序数依次增大的五种短周期主族元素。R最常见同位素的原子核中不含中子。W与X可形成两种稳定的化合物:WX和WX2。工业革命以来,人类使用的化石燃料在燃烧过程中将大量WX2排入大气,在一定程度导致地球表面平均温度升高。Y与 X 是同一主族的元素,且在元素周期表中与X相邻。
(1)W的原子结构示意图是_______________。
(2)WX2的电子式是________________。
(3)R2X、R2Y中,稳定性较高的是___________(填化学式),请从原子结构的角度解释其原因:_____________________。
(4)Se与Y是同一主族的元素,且在元素周期表中与Y相邻。
①根据元素周期律,下列推断正确的是___________填字母序号)。
a.Se的最高正化合价为+7价
b.H2Se的还原性比H2Y强
c.H2SeO3的酸性比H2YO4强
d.SeO2在一定条件下可与NaOH溶液反应
②室温下向SeO2固体表面吹入NH3,可得到两种单质和H2O,该反应的化学方程式为_______。
【答案】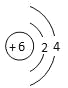
![]() H2O O与S为同主族元素,O的电子层数小于S,O的原子半径小于S,O的原子核对核外电子吸引能力大于S原子,O的非金属性强于S,故H2O的稳定性大于 H2S。 bd 3SeO2+ 4NH3=3Se + 2N2+ 6H2O
H2O O与S为同主族元素,O的电子层数小于S,O的原子半径小于S,O的原子核对核外电子吸引能力大于S原子,O的非金属性强于S,故H2O的稳定性大于 H2S。 bd 3SeO2+ 4NH3=3Se + 2N2+ 6H2O
【解析】
R、W、X、Y、M是原子序数依次增大的五种短周期主族元素。R最常见同位素的原子核中不含中子,R为H元素;W与X可形成两种稳定的化合物:WX和WX2,工业革命以来,人类使用的化石燃料在燃烧过程中将大量WX2排入大气,在一定程度导致地球表面平均温度升高,则W为C元素、X为O元素;Y与X是同一主族的元素,且在元素周期表中与X相邻,Y为S元素;M的原子序数最大,M为Cl元素,据此分析解答。
由上述分析可知,R、W、X、Y、M五种短周期主族元素分别为H、C、O、S、Cl。
(1)C的原子结构示意图是![]() ,故答案为:
,故答案为:![]() ;
;
(2)WX2为CO2,电子式为![]() ,故答案为:
,故答案为:![]() ;
;
(3)R2X、R2Y分别为H2O和H2S,O与S为同主族元素,O的电子层数小于S,O的原子半径小于S,O的原子核对核外电子吸引能力大于S原子,O的非金属性强于S,故H2O的稳定性大于H2S,稳定性较高的是H2O,故答案为:H2O;O与S为同主族元素,O的电子层数小于S,O的原子半径小于S,O的原子核对核外电子吸引能力大于S原子,O的非金属性强于S,故H2O的稳定性大于H2S;
(4)①a.Se的最外层电子数为6,最高正化合价为+6价,故a错误;b.非金属性S大于Se,则H2Se的还原性比H2S强,故b正确;c.H2SeO3为弱酸,H2SO4为强酸,故c错误;d.SeO2为酸性氧化物,一定条件下可与NaOH溶液反应生成盐和水,故d正确;故答案为:bd;
②室温下向SeO2固体表面吹入NH3,可得到两种单质和H2O,该反应的化学方程式为3SeO2+4NH3═3Se+2N2+6H2O,故答案为:3SeO2+4NH3═3Se+2N2+6H2O。


科目:高中化学 来源: 题型:
【题目】运用有关概念判断下列叙述正确的是
A.碱性氧化物都是金属氧化物,有些金属氧化物是酸性氧化物
B.Na2SO3能被Fe3+、H2O2、浓硝酸、浓硫酸、氯气等氧化剂氧化
C.![]() 互为同系物
互为同系物
D.BaSO4的水溶液不易导电,其电离方程式为BaSO4(s)![]() Ba2+(aq)+SO42-(aq)
Ba2+(aq)+SO42-(aq)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 均为原子序数小于18的常见元素,且原子序数依次增大。已知
均为原子序数小于18的常见元素,且原子序数依次增大。已知![]() 原子最外层电子数与核外电子总数之比为
原子最外层电子数与核外电子总数之比为![]() ,
,![]() 原子的最外层电子数与次外层电子数之比为
原子的最外层电子数与次外层电子数之比为![]() ;
;![]() 比
比![]() 的原子序数小1;
的原子序数小1;![]() 与
与![]() 的电子层结构相同;化合物
的电子层结构相同;化合物![]() 在常温下为气体。请回答下列问题:
在常温下为气体。请回答下列问题:
(1)写出![]() 的简单离子的结构示意图:______。
的简单离子的结构示意图:______。
(2)由![]() 、
、![]() 、
、![]() 三种元素形成的盐的化学式为____________。
三种元素形成的盐的化学式为____________。
(3)![]() 与
与![]() 可形成2种分子,分别为10电子和18电子的分子,写出该18电子分子转化成10电子分子的化学方程式:____________。
可形成2种分子,分别为10电子和18电子的分子,写出该18电子分子转化成10电子分子的化学方程式:____________。
(4)写出![]() 的单质的一种工业用途:____________。
的单质的一种工业用途:____________。
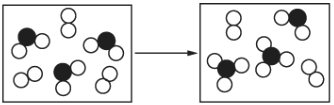
(5)如图表示由上述元素中的某两种元素组成的气体分子在密闭容器中,一定条件下充分反应前后的转化关系,该转化过程的化学方程式为____________。
(6)![]() 是由
是由![]() 、
、![]() 、
、![]() 、
、![]() 四种元素组成的一种化合物,已知
四种元素组成的一种化合物,已知![]() 既能与盐酸反应,又能与
既能与盐酸反应,又能与![]() 溶液反应,还能和氯水反应,写出
溶液反应,还能和氯水反应,写出![]() 与氯水反应的离子方程式:__________________。
与氯水反应的离子方程式:__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知短周期主族元素X、Y、Z、W的原子序数依次增大,X元素原子的最外层电子数是内层电子数的3倍,Y与X能形成两种化合物,Z所在的周期序数与族序数相同。下列说法正确的是( )
A.Y的单质能从Z的盐溶液中置换出Z
B.简单氢化物的热稳定性:![]()
C.Z与X两元素不能形成阴离子
D.简单离子的半径大小:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W为四种常见元素,其中X、Y、Z为短周期元素。有关信息如表所示.
原子或分子相关信息 | 单质或化合物相关信息 | |
X |
| X的最高价氧化物对应的水化物为无机酸中的最强酸 |
Y | Y原子的最外层电子数等于电子层数 | Y的氧化物是典型的两性氧化物,可用于制造一种极有前途的高温材料 |
Z | Z原子的最外层电子数是次外层电子数的 | Z是无机非金属材料的主角,其单质是制取大规模集成电路的主要原料 |
W | W原子的最外层电子数小于4 | W的常见化合价有 |
(1)W在周期表中的位置为______,![]() 在空气中不稳定,极易被氧化,由白色迅速变成灰绿色,最后变成红褐色,反应的化学方程式为______
在空气中不稳定,极易被氧化,由白色迅速变成灰绿色,最后变成红褐色,反应的化学方程式为______
(2)X的简单阴离子的结构示意图为______,X的最高价氧化物对应水化物的水溶液与Y的氧化物反应的离子方程式为________
(3)Z的氧化物在通讯领域用来作______,工业上制备Z的单质的化学反应方程式为______。锗与Z是同一主族元素,它可用来制造半导体品体管.研究表明:有机锗具有明显的抗肿瘤活性,锗不与![]() 溶液反应但在有
溶液反应但在有![]() 存在时可与
存在时可与![]() 溶液反应生成锗酸盐,反应的化学方程式为_______
溶液反应生成锗酸盐,反应的化学方程式为_______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W、M、R、Q是短周期主族元素,部分元素的原子半径和化合价信息如下表所示:
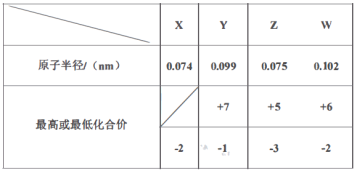
M的焰色反应为黄色:X、Y、R位于周期表中不同周期;Q的单质为半导体材料。
(1)Q元素在周期表中的位置是___;构成化合物M2X2的化学键类型是___。
(2)写出X、Y、R按原子个数之比为1:1:1形成的化合物的电子式___。
(3)Y与W相比,非金属性较强的是___(用元素符号表示),下列事实能证明这一结论的是___(选填字母序号)。
a.常温下W的单质呈固态,Y的单质呈气态
b.Y与W形成的化合物中W呈正价
c.Y和M反应时,lmolY原子所得电子数少于lmolW原子所得电子数
(4)R、W两种元素组成的离子在水溶液中与H+和OH-都不能大量共存,还能与氯水反应,写出其与新制氯水反应的离子方程式___。
(5)Z2R4为二元弱碱,在水中的电离与氨相似,写出其在水中的第一步电离方程式___,Z2R4与磷酸形成的磷酸二氢盐的化学式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝是应用广泛的金属,以铝土矿(主要成分为A12O3,含SiO2和Fe2O3等杂质)为原料制备铝的一种工艺流程如图:

已知:SiO2在“碱溶”时转化为铝硅酸钠沉淀。
(1)“碱溶”时生成偏铝酸钠的离子方程式为__。
(2)“滤渣Ⅰ”的成分有___。
(3)向“过滤Ⅰ”所得滤液中通入足量的CO2,反应的离子方程式为___。
(4)“滤液Ⅱ”中加入足量的CaO,生成的__(填化学式)可循环利用。
(5)“灼烧”的化学方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于元素周期律的叙述正确的是( )
A.随着元素原子序数的递增,原子最外层电子数从1到8(第1周期元素及过渡元素除外)重复出现
B.随着元素原子序数的递增,元素最高正化合价从+1到+7、负化合价从-7到-1重复出现
C.随着元素原子序数的递增,原子(稀有气体元素原子除外)半径从小到大发生周期性变化
D.元素性质的周期性变化是元素原子核外电子排布周期性变化的必然结果
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】AG 定义为 AG= lg![]() ,若用 AG 来表示溶液的酸度,说法不正确的是
,若用 AG 来表示溶液的酸度,说法不正确的是
A.在一定温度下,溶液的酸性越强,AG 越大
B.65℃时,pH 与 AG 的换算公式为 AG = 2 (7 – pH)
C.若溶液显碱性,则 AG < 0
D.若溶液显中性,则 AG = 0
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com