
【题目】运用有关概念判断下列叙述正确的是
A.碱性氧化物都是金属氧化物,有些金属氧化物是酸性氧化物
B.Na2SO3能被Fe3+、H2O2、浓硝酸、浓硫酸、氯气等氧化剂氧化
C.![]() 互为同系物
互为同系物
D.BaSO4的水溶液不易导电,其电离方程式为BaSO4(s)![]() Ba2+(aq)+SO42-(aq)
Ba2+(aq)+SO42-(aq)
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】1934年,居里夫妇用![]() 粒子
粒子![]() 轰击
轰击![]() 得到一种自然界中不存在的磷元素的一种核素
得到一种自然界中不存在的磷元素的一种核素![]() :
:![]() ,开创了人造核素的先河。
,开创了人造核素的先河。
(1)下列有关说法正确的有______(填序号)。
A.![]() 的质子数是27 B.
的质子数是27 B.![]() 是一种电中性粒子
是一种电中性粒子
C.![]() 和
和![]() 互为同位素 D.P元素的相对原子质量为30
互为同位素 D.P元素的相对原子质量为30
(2)元素的化学性质主要取决于______(填序号)。
A.原子最外层电子数 B.原子核内中子数
C.原子核内质子数 D.原子质量数
(3)不同种元素的本质区别是______(填序号)。
A.原子的质子数不同 B.原子的中子数不同
C.原子的最外层电子数不同 D.原子的质量数不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)为了检验和除去表中的各种杂质(括号里的为杂质),请从①中选出适当的检验试剂,从②中选出适当的除杂试剂,将所选的答案用字母填入相应的空格内。
物质 | 检验试剂 | 除杂试剂 |
(Ⅰ)甲烷(乙烯) | ____ | ____ |
(Ⅱ)酒精(水) | ____ | ____ |
①检验的试剂:a.无水硫酸铜b.酸性高锰酸钾溶液c.水d.氢氧化钠溶液
②除杂试剂:a.无水硫酸铜b.乙酸c.新制的生石灰d.溴水
(2)如图所示,在左试管中先加入2 mL 95%的乙醇,并在摇动下缓缓加入3 mL浓硫酸,再加入2 mL乙酸,充分摇匀。按图连接好装置,用酒精灯对左试管小火加热3~5 min后,改用大火加热,当观察到右试管中有明显现象时停止实验。
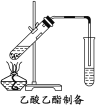
试回答:在右试管中通常加入__________溶液,实验生成的乙酸乙酯,其密度比水小,是有特殊香味的液体。分离右试管中所得乙酸乙酯的操作为__________(只填名称)。反应中加入浓硫酸的作用是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)一定温度下,向1L0.1molL-1CH3COOH溶液中加入0.1molCH3COONa固体,则醋酸的电离平衡向_____(填“正”或“逆”)反应方向移动;溶液中![]() 的值_____ (填“增大”、“减小”或“不变”)。
的值_____ (填“增大”、“减小”或“不变”)。
(2)氨气的水溶液称为氨水,其中存在的主要溶质微粒是NH3H2O,已知:
a.常温下,CH3COOH和NH3H2O的电离平衡常数均为1.74×10-5;b.CH3COOH+NaHCO3=CH3COONa+CO2↑+H2O。
则CH3COONH4溶液呈______性(填“酸”、“碱”或“中”),NH4HCO3溶液呈______性;NH4HCO3溶液中物质的量浓度最大的离子是_____。
(3)99℃时,Kw=1.0×10-12,该温度下测得0.1molL-1Na2A溶液的pH=6。
①H2A在水溶液中的电离方程式为______。
②该温度下,将0.01molL-1H2A溶液稀释到20倍后,溶液的pH=______。
③体积相等、pH=1的盐酸与H2A溶液分别与足量的Zn反应,产生的氢气______。
A.盐酸多 B.H2A多 C.一样多 D.无法确定
④将0.1molL-1H2A溶液与0.2molL-1氨水等体积混合,完全反应后溶液中各离子浓度从大到小的顺序为______。
(4)人们配制氯化铁溶液时,常将氯化铁晶体先溶于_____,然后再加水稀释,通过增加溶液中______离子的浓度,来抑制铁离子的水解,当实验室制备氢氧化铁胶体时,常采用的方法是向_______中滴加数滴氯化铁溶液,并持续加热至沸腾,以促进铁离子的水解。
(5)欲除去硫酸铜溶液中混有的少量铁离子和亚铁离子,可向溶液中加入少量稀硫酸和_____,再向溶液中加入_______和_____,调节溶液的pH至3~4,使含铁杂质离子转化为氢氧化铁沉淀而除去。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图中A~H均为中学化学中常见的物质,A、B、H为气体,反应①是重要的工业反应,它们之间有如下转化关系(反应中生成的水已略去)。

请回答以下问题:
(1)B是_____,D是_____,G是_____,H是_____(填化学式)。
(2)工业上常利用反应①制取漂白粉,该反应的化学方程式:__________,漂白粉溶于水后,受空气中的CO2作用,即产生有漂白、杀菌作用的次氯酸,化学反应方程式为_________。
(3)A中元素的原子结构示意图为________。
(4)F在溶液中的电离方程式为_________。
(5)上述反应中属于氧化还原反应的是_______(填写序号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,反应前后固体物质的质量不变的是( )
A.氢气通过灼热的CuO粉末B.二氧化碳通过Na2O2粉末
C.铝与Fe2O3发生铝热反应D.将锌粒投入Cu(NO3)2溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将镁、铝的混合物0.1mol溶于100mL 2mol/L的H2S04溶液中,然后再滴加1mol/L的NaOH 溶液.请回答:

(1)若在滴加NaOH溶液的过程中,沉淀质量随加入NaOH溶液的体积V变化如图所示.当V1=160mL时,则金属粉末中,n(Mg)= mol,V2= mL.
(2)若在滴加NaOH溶液的过程中,欲使Mg2+、A13+刚好沉淀完全,则滴入NaOH溶液的体积 mL.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环之间共用一个碳原子的化合物称为螺环化合物,螺[3,3]庚烷(![]() )是其中的一种。下列关于该化合物的说法正确的是
)是其中的一种。下列关于该化合物的说法正确的是
A. 与甲苯(C7H8)互为同分异构体
B. 1mol该化合物完全燃烧时消耗10 mol O2
C. 所有碳原子均处同一平面
D. 一氯代物共有3种(不含立体异构)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】R、W、X、Y、M是原子序数依次增大的五种短周期主族元素。R最常见同位素的原子核中不含中子。W与X可形成两种稳定的化合物:WX和WX2。工业革命以来,人类使用的化石燃料在燃烧过程中将大量WX2排入大气,在一定程度导致地球表面平均温度升高。Y与 X 是同一主族的元素,且在元素周期表中与X相邻。
(1)W的原子结构示意图是_______________。
(2)WX2的电子式是________________。
(3)R2X、R2Y中,稳定性较高的是___________(填化学式),请从原子结构的角度解释其原因:_____________________。
(4)Se与Y是同一主族的元素,且在元素周期表中与Y相邻。
①根据元素周期律,下列推断正确的是___________填字母序号)。
a.Se的最高正化合价为+7价
b.H2Se的还原性比H2Y强
c.H2SeO3的酸性比H2YO4强
d.SeO2在一定条件下可与NaOH溶液反应
②室温下向SeO2固体表面吹入NH3,可得到两种单质和H2O,该反应的化学方程式为_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com