
【题目】已知![]() 、
、![]() 均为短周期元素,A元素的阳离子与B元素的阴离子具有相同的电子层结构,有关两元素有以下叙述:①原子序数:A>B;②原子半径:A<B;③离子半径:A>B;④原子最外层电子数:A≤B,其中正确的是( )
均为短周期元素,A元素的阳离子与B元素的阴离子具有相同的电子层结构,有关两元素有以下叙述:①原子序数:A>B;②原子半径:A<B;③离子半径:A>B;④原子最外层电子数:A≤B,其中正确的是( )
A.①②B.①④C.②③D.②③④
科目:高中化学 来源: 题型:
【题目】无色孔雀石绿(结构简式如图所示)曾被用作水产养殖业的杀虫剂(鱼药)。因为具有潜在致癌性,已被禁止用作鱼药,下列关于无色孔雀石绿的叙述中,正确的是( )
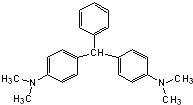
A.分子中所有的碳原子可能在同一平面上
B.无色孔雀石绿与氢气完全加成后的产物的核磁共振氢谱中有7个峰
C.无色孔雀石绿可与溴水中的溴发生加成反应
D.在一定条件下,1mol无色孔雀石绿可以和9mol氢气发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳、氮是中学化学重要的非金属元素,在生产、生活中有广泛的应用。
(1)治理汽车尾气中NO和CO的一种方法是:在汽车的排气管道上安装一个催化转化装置,使NO与CO反应,产物都是空气中的主要成分。写出该反应的热化学方程式___。
已知:①N2(g)+O2(g)=2NO(g) △H=+179.5kJ/mol
②2NO(g)+O2(g)=2NO2(g) △H=-112.3kJ/mol
③NO2(g)+CO(g)=NO(g)+CO2(g) △H=-234kJ/mol
(2)己知植物光合作用发生的反应如下:
6CO2(g)+6H2O(l)![]() C6H12O6(s)+6O2(g) △H=+669.62 kJ/mol
C6H12O6(s)+6O2(g) △H=+669.62 kJ/mol
该反应达到化学平衡后,若改变下列条件,CO2转化率增大的是___。
a.增大CO2的浓度 b.取走一半C6H12O6 c.加入催化剂 d.适当升高温度
(3)N2O5的分解反应2N2O5(g)![]() 4NO2(g)+O2(g),由实验测得在67℃时N2O5的浓度随时间的变化如下:
4NO2(g)+O2(g),由实验测得在67℃时N2O5的浓度随时间的变化如下:
时间/min | 0 | 1 | 2 | 3 | 4 | 5 |
C(N2O5)/(mol·L-1) | 1.00 | 0.71 | 0.50 | 0.35 | 0.25 | 0.17 |
计算在0~2min时段,化学反应速率v(NO2)=___molL-1min-1。
(4)新的研究表明,可以将CO2转化为炭黑进行回收利用,反应原理如图所示。
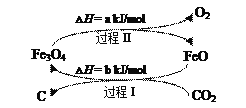
①在转化过程中起催化作用的物质是___;
②写出总反应的化学方程式___。
(5)工业上以NH3和CO2为原料合成尿素[CO(NH2)2),反应的化学方程式如下:2NH3(g)+CO2(g)![]() CO(NH2)2(l)+H2O(l)根据上述反应,填写下列空白
CO(NH2)2(l)+H2O(l)根据上述反应,填写下列空白
①己知该反应可以自发进行,则△H___0。(填“>”、“<”或“=”);
②一定温度和压强下,若原料气中的NH3和CO2的物质的量之比![]() =x,如图是x与CO2的平衡转化率(α)的关系。α随着x增大而增大的原因是___;B点处,NH3的平衡转化率为___。
=x,如图是x与CO2的平衡转化率(α)的关系。α随着x增大而增大的原因是___;B点处,NH3的平衡转化率为___。
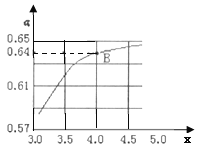
③一定温度下,在3L定容密闭容器中充入NH3和CO2,若x=2,当反应后气体压强变为起始时气体压强的![]() 时达到平衡,测得此时生成尿素90g。该反应的平衡常数K=___。
时达到平衡,测得此时生成尿素90g。该反应的平衡常数K=___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知![]() 、
、![]() 均为短周期元素,A元素的阳离子与B元素的阴离子具有相同的电子层结构,有关两元素有以下叙述:①原子序数:A>B;②原子半径:A<B;③离子半径:A>B;④原子最外层电子数:A≤B,其中正确的是( )
均为短周期元素,A元素的阳离子与B元素的阴离子具有相同的电子层结构,有关两元素有以下叙述:①原子序数:A>B;②原子半径:A<B;③离子半径:A>B;④原子最外层电子数:A≤B,其中正确的是( )
A.①②B.①④C.②③D.②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出下列反应的化学方程式:
(1)苯制备溴苯___________________。
(2)制备TNT_____________________。
(3)2溴丙烷消去反应______________。
(4)实验室制乙烯__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钴元素是三元锂离子电池阳极材料的重要成分。请回答下列问题:
(1)钴元素在周期表中的位置是___________,其外围电子排布式为___________。
(2)已知第四电离能大小:I4(Fe)> I4 (Co),从原子结构的角度分析可能的原因是___________。
(3)配位化学创始人维尔纳发现,取1mol配合物CoCl3·6NH3(黄色)溶于水,加人足量硝酸银溶液,产生3mol白色沉淀,沉淀不溶于稀硝酸。原配合物中络离子形状为正八面体。
①根据上述事实推测原配合物中络离子化学式为___________。
②该配合物在热NaOH溶液中发生反应,并释放出气体,该反应的化学方程式___________;生成气体分子的中心原子杂化方式为___________。
(4)经X射线衍射测定发现,晶体钴在417℃以上堆积方式的剖面图如图所示,则该堆积方式属于___________,若该堆积方式下的晶胞参数为acm,则钴原子的半径为___________pm。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中科院深圳先进技术研究院成功研发了一种高效低成本储能电池——“铝一石墨”双离子电池,电池总反应为Al+xC+Li++PF6 -![]() AlLi+Cx PF6下列有关该电池的说法正确的是
AlLi+Cx PF6下列有关该电池的说法正确的是
A. 放电时,PF6-向正极移动
B. 放电时,负极反应为A1-3e-====Al3+
C. 充电时,两个电极增加的质量相等
D. 充电时,阳极反应为xC+PF6--e-==CxPF6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通常状况下,![]() 、
、![]() 和
和![]() 是三种气态单质。
是三种气态单质。![]() 的组成元素是第3周期原子半径最小的元素(稀有气体元素除外);
的组成元素是第3周期原子半径最小的元素(稀有气体元素除外);![]() 和
和![]() 均由元素
均由元素![]() 组成,
组成,![]() 能氧化
能氧化![]() ,反应的离子方程式为
,反应的离子方程式为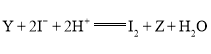 。
。
(1)写出物质的分子式:![]() ______,
______,![]() ______,
______,![]() ______。
______。
(2)![]() 与
与![]() 的关系是______(填序号)。
的关系是______(填序号)。
a.互为同位素 b.属于同一物质
c.互为同素异形体 d.互为同分异构体
(3)导致大气中![]() 减少的主要物质是______。
减少的主要物质是______。
(4)将![]() 和二氧化硫分别通入品红溶液中,都能使品红溶液褪色。利用褪色的溶液区别二者的实验方法是________________________。
和二氧化硫分别通入品红溶液中,都能使品红溶液褪色。利用褪色的溶液区别二者的实验方法是________________________。
(5)举例说明![]() 的氧化性比硫单质的氧化性强:________________________(用化学方程式表示)。
的氧化性比硫单质的氧化性强:________________________(用化学方程式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知 A、B、C、D、E 都是周期表中前四周期的元素,且原子序数依次增大,其中 A 原子核外 有三个未成对电子;A 与 B 可形成离子化合物 B3A2;C 元素是地壳中含量最高的金属元素;D 原 子核外的 M 层中有两对成对电子;E 原子核外最外层只有 1 个电子,其余各层电子均充满。以下 有关说法正确的是
A.A 离子半径小于 B 离子半径
B.B 和 C 的氯化物晶体类型相同
C.C 和 D 形成的二元化合物不能通过复分解反应得到
D.E 在周期表中位于第四周期 s 区
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com