
【题目】碳、氮是中学化学重要的非金属元素,在生产、生活中有广泛的应用。
(1)治理汽车尾气中NO和CO的一种方法是:在汽车的排气管道上安装一个催化转化装置,使NO与CO反应,产物都是空气中的主要成分。写出该反应的热化学方程式___。
已知:①N2(g)+O2(g)=2NO(g) △H=+179.5kJ/mol
②2NO(g)+O2(g)=2NO2(g) △H=-112.3kJ/mol
③NO2(g)+CO(g)=NO(g)+CO2(g) △H=-234kJ/mol
(2)己知植物光合作用发生的反应如下:
6CO2(g)+6H2O(l)![]() C6H12O6(s)+6O2(g) △H=+669.62 kJ/mol
C6H12O6(s)+6O2(g) △H=+669.62 kJ/mol
该反应达到化学平衡后,若改变下列条件,CO2转化率增大的是___。
a.增大CO2的浓度 b.取走一半C6H12O6 c.加入催化剂 d.适当升高温度
(3)N2O5的分解反应2N2O5(g)![]() 4NO2(g)+O2(g),由实验测得在67℃时N2O5的浓度随时间的变化如下:
4NO2(g)+O2(g),由实验测得在67℃时N2O5的浓度随时间的变化如下:
时间/min | 0 | 1 | 2 | 3 | 4 | 5 |
C(N2O5)/(mol·L-1) | 1.00 | 0.71 | 0.50 | 0.35 | 0.25 | 0.17 |
计算在0~2min时段,化学反应速率v(NO2)=___molL-1min-1。
(4)新的研究表明,可以将CO2转化为炭黑进行回收利用,反应原理如图所示。
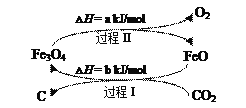
①在转化过程中起催化作用的物质是___;
②写出总反应的化学方程式___。
(5)工业上以NH3和CO2为原料合成尿素[CO(NH2)2),反应的化学方程式如下:2NH3(g)+CO2(g)![]() CO(NH2)2(l)+H2O(l)根据上述反应,填写下列空白
CO(NH2)2(l)+H2O(l)根据上述反应,填写下列空白
①己知该反应可以自发进行,则△H___0。(填“>”、“<”或“=”);
②一定温度和压强下,若原料气中的NH3和CO2的物质的量之比![]() =x,如图是x与CO2的平衡转化率(α)的关系。α随着x增大而增大的原因是___;B点处,NH3的平衡转化率为___。
=x,如图是x与CO2的平衡转化率(α)的关系。α随着x增大而增大的原因是___;B点处,NH3的平衡转化率为___。
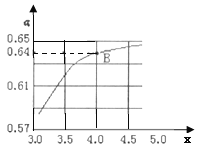
③一定温度下,在3L定容密闭容器中充入NH3和CO2,若x=2,当反应后气体压强变为起始时气体压强的![]() 时达到平衡,测得此时生成尿素90g。该反应的平衡常数K=___。
时达到平衡,测得此时生成尿素90g。该反应的平衡常数K=___。
【答案】2NO(g)+2CO(g)![]() N2(g)+2CO2(g) △H=-795.8kJ/mol d 0.5 FeO
N2(g)+2CO2(g) △H=-795.8kJ/mol d 0.5 FeO ![]() <
< ![]() 越大,
越大,![]() 的物质的量越大,
的物质的量越大,![]() 平衡正向移动,转化率增大
平衡正向移动,转化率增大 ![]() 0.25(mol/L)-3
0.25(mol/L)-3
【解析】
(1)产物都是空气中的主要成分,所以会生成![]() 和
和![]() ,根据盖斯定律,
,根据盖斯定律,![]() 其热化学方应方程式为:
其热化学方应方程式为:![]() ;
;
(2)a. 增大![]() 的浓度,
的浓度,![]() 的转化率不一定增大,a错误;
的转化率不一定增大,a错误;
b. C6H12O6是固体,对平衡无影响,b错误;
c. 催化剂只改变反应速率,不改变平衡移动,对转化率无影响,c错误;
d. 该反应为吸热反应,升高温度,平衡向正反应方向移动,![]() 转化率增大,d正确;
转化率增大,d正确;
(3)据速率之比等于化学反应系数之比,![]() ,
,
(4)根据图可知,![]() 是催化剂,总反应方程式为:
是催化剂,总反应方程式为:![]()
(5)①该反应为反应前后气体分子数减小的反应,根据![]() ,
, ![]() ,能自发进行
,能自发进行![]() ,所以
,所以![]() ;
;
②![]() 越大,
越大,![]() 的物质的量越大,平衡正向移动,
的物质的量越大,平衡正向移动,![]() 转化率增大;
转化率增大;![]() 点处
点处![]() ,原料气中
,原料气中![]() 和
和![]() 的物质的量比为
的物质的量比为![]() ,
,![]() 转化率为
转化率为![]() ,假设
,假设![]() 为
为![]() ,
,![]() 为
为![]() ,则反应的
,则反应的![]() 的物质的量为
的物质的量为![]() ,根据热反应方程式可知,反应的
,根据热反应方程式可知,反应的![]() 的物质的量为
的物质的量为![]() ,其转化率为
,其转化率为![]() ;
;
③![]() ,原料气中
,原料气中![]() 和
和![]() 的物质的量比为
的物质的量比为![]() ,假设
,假设![]() 为
为![]() ,
,![]() 为
为![]() ,设转化的
,设转化的![]() 为
为![]() ,其三段式为:
,其三段式为:
2NH3(g)+CO2(g)![]() CO(NH2)2(l)+H2O(l)
CO(NH2)2(l)+H2O(l)
始/ mol 2x x 0 0
转/ mol 2n n n n
平/ mol (2x-2n) (x-n) n n
相同条件下,压强之比等于物质的量之比,平衡时,反应后气体压强变为起始时气体压强的![]() ,其
,其 ![]() ,
,![]() ,此时生成尿素
,此时生成尿素![]() ,尿素的物质的量为
,尿素的物质的量为![]() ,
,![]() ,体积为
,体积为![]() ,其平衡常数为:
,其平衡常数为:![]()


 名题金卷系列答案
名题金卷系列答案科目:高中化学 来源: 题型:
【题目】一种新型漂白剂结构如图所示,其中W、Y、Z为不同周期不同主族的短周期元素,W、Y、Z的最外层电子数之和等于X的最外层电子数,W、X对应的简单离子核外电子排布相同。下列说法正确的是( )
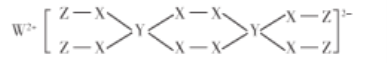
A.非金属性:X>W>Y
B.Y的最高价氧化为对应的水化物为三元酸
C.可利用W与X形成的化合物制备耐高温材料
D.该漂白剂中仅有X均满足8电子稳定结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z三种短周期元素,原子半径的大小关系为![]() ,原子序数之和为16。X、Y、Z三种元素的常见单质在适当条件下可发生如图所示变化,其中B和C均为10电子分子。下列说法不正确的是( )
,原子序数之和为16。X、Y、Z三种元素的常见单质在适当条件下可发生如图所示变化,其中B和C均为10电子分子。下列说法不正确的是( )
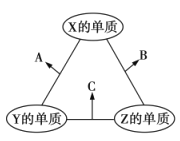
A.X元素位于ⅥA族
B.A不能溶解于B中
C.B的稳定性强于C
D.A和C不可能发生氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 为短周期元素,且原子序数依次递增。
为短周期元素,且原子序数依次递增。![]() 、
、![]() 同主族,
同主族,![]() 、
、![]() 同主族。
同主族。![]() 与其他非金属元素化合时易形成共价键,
与其他非金属元素化合时易形成共价键,![]() 与其他非金属元素化合时易形成离子键,且离子
与其他非金属元素化合时易形成离子键,且离子![]() 与
与![]() 的核外电子排布相同。气态分子
的核外电子排布相同。气态分子![]() 和
和![]() 具有相同的电子数,
具有相同的电子数,![]() 是空气中含量最高的物质。请回答下列问题:
是空气中含量最高的物质。请回答下列问题:
(1)![]() 位于第______周期______族;
位于第______周期______族;
(2)![]() 的简单离子结构示意图为______;
的简单离子结构示意图为______;
(3)![]() 的电子式是______;
的电子式是______;
(4)由![]() 、
、![]() 、
、![]() 三种元素形成的化合物的化学式为______,含有的化学键类型有______,属于______(填“共价”或“离子”)化合物。
三种元素形成的化合物的化学式为______,含有的化学键类型有______,属于______(填“共价”或“离子”)化合物。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化铁的用途较为广泛。工业上用废铁屑制备氧化铁的流程如图:
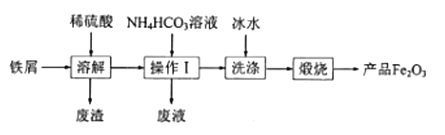
(1)“溶解”时主要反应的离子方程式为___。
(2)操作Ⅰ的名称是___。
(3)加入 NH4HCO3溶液生成FeCO3沉淀和CO2,则“废液”中含有的主要离子有___。
(4)在空气中煅烧FeCO3可得产品Fe2O3,写出该反应的化学方程式:___。实际生产时,产品Fe2O3中常混有FeO。为了减少FeO,“煅烧”时可以采取的措施有___(写一条)。
(5)产品Fe2O3与A粉的混合物称为铝热剂,可用于焊接铁轨。该反应的化学方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】《焦点访谈》栏目中曾报道“铊中毒事件”,铊再次成为公众关注的焦点。已知铊有两种天然同位素![]() 和
和![]() 。下列关于
。下列关于![]() 说法正确的是( )
说法正确的是( )
A. 中子数与质子数之差为122B. 中子数与电子数之差为122
C. 质量数与中子数之差为81D. 质量数与电子数之差为81
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知![]() 、
、![]() 均为短周期元素,A元素的阳离子与B元素的阴离子具有相同的电子层结构,有关两元素有以下叙述:①原子序数:A>B;②原子半径:A<B;③离子半径:A>B;④原子最外层电子数:A≤B,其中正确的是( )
均为短周期元素,A元素的阳离子与B元素的阴离子具有相同的电子层结构,有关两元素有以下叙述:①原子序数:A>B;②原子半径:A<B;③离子半径:A>B;④原子最外层电子数:A≤B,其中正确的是( )
A.①②B.①④C.②③D.②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应aA(g)+bB(g)cC(g) ΔH<0在等容条件下进行。改变其它反应条件,在I、II、III阶段体系中各物质浓度随时间变化的曲线如图所示,下列说法不正确的是
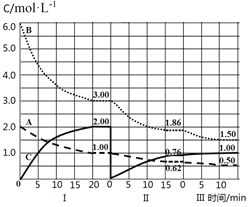
A.反应的化学方程式中,a:b:c=1:3:2
B.第II阶段反应温度小于第III阶段反应温度
C.A的平均反应速率vⅠ(A)、vⅡ(A)、vⅢ(A),最大的是vⅠ(A)
D.由第一次平衡到第二次平衡,采取的措施是从反应体系中移走C
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com