
【题目】CH4-CO2催化重整可以得到合成气(CO和H2),有利于减小温室效应,其主要反应为CH4(g)+CO2(g)2CO(g)+2H2(g) ΔH=+247 kJ·mol1,同时存在以下反应:积碳反应:CH4(g)C(s)+2H2(g) ΔH=+75 kJ·mol1,消碳反应:CO2(g)+C(s)2CO(g) ΔH=+172 kJ·mol1,积碳会影响催化剂的活性,一定时间内积碳量和反应温度的关系如图。下列说法正确的是

A.高压利于提高 CH4 的平衡转化率并减少积碳
B.增大CO2与CH4的物质的量之比有助于减少积碳
C.升高温度,积碳反应的化学平衡常数K减小,消碳反应的K增大
D.温度高于600℃,积碳反应的化学反应速率减慢,消碳反应的化学反应速率加快, 积碳量减少
【答案】B
【解析】
A.反应CH4(g)+CO2(g)2CO(g)+2H2(g)和CH4(g)C(s)+2H2(g),正反应是气体体积增大的反应,增大压强,平衡逆向移动,可减少积碳,但CH4的平衡转化率降低,故A错误;
B.假设CH4的物质的量不变,增大CO2的物质的量,CO2与CH4的物质的量之比增大,对于反应CH4(g)+CO2(g)2CO(g)+2H2(g)平衡正向移动,CH4的浓度减小,对于积碳反应:CH4(g) C(s) +2H2(g),由于甲烷浓度减小,平衡逆向移动,碳含量减少;增大CO2的物质的量,对于消碳反应:CO2(g) +C(s) 2CO(g),平衡正向移动,碳含量也减少,综上分析,增大CO2与CH4的物质的量之比,有助于减少积碳,故B正确;
C.平衡常数只与温度有关,积碳反应和消碳反应都是吸热反应,升高温度,平衡向吸热的方向移动,即向正向移动,两个反应的平衡常数K都增大,故C错误;
D.根据图像,温度高于600℃,积碳量减少,但温度升高,存在的反应体系中反应速率都加快,故D错误;
答案选B。


 53天天练系列答案
53天天练系列答案科目:高中化学 来源: 题型:
【题目】化学与社会生活密切相关,下列说法正确的是( )
A.军舰船底镶嵌锌块作正极,以防船体被腐蚀
B.汽车尾气中NO和CO可以缓慢反应生成N2和CO2,减小压强,反应速率减慢
C.金属冶炼过程是金属离子得电子变成金属单质的氧化过程
D.PM2.5颗粒![]() 微粒直径约为2.5×106m)分散在空气中形成气溶胶
微粒直径约为2.5×106m)分散在空气中形成气溶胶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A. 3.2g铜溶于过量的浓硝酸完全反应生成的气体的物质的量一定为0.1mol
B. 78gNa2S和Na2O2的混合物中阳离子与阴离子的个数比不能确定
C. 25℃HCN的电离平衡常数为5.0×10-10,则浓度均为0.10mol·L-1NaCN和HCN的混合溶液中有c(Na+)>c(CN-)>c(OH-) >c(H+)
D. Fe(NO3)2溶液中加入过量的HI溶液:Fe2++NO3-+4H++2I-=I2+Fe3++NO↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组同学为探究同周期元素性质的递变规律,设计了如下实验。
(1)将等质量的钠、镁、铝分别投入到足量的相同浓度的盐酸中,试预测实验结果:上述金属中___(填化学式,下同)与盐酸反应最剧烈,___与盐酸反应生成的气体最多。
(2)向Na2S溶液中通入氯气出现淡黄色浑浊现象,可证明S、Cl元素非金属性强弱顺序为___,反应的离子方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1) 写出CO2的空间构型:___________。
(2) 写出Na3N的电子式:____________________。
(3) 写出C2H6O的化学名称:______________________。
(4) 写出乙烯的实验式:_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,两套实验装置中进行的实验都涉及金属的腐蚀,假设其中的金属块和金属丝都是足量的。下列叙述正确的是( )
Ⅰ Ⅱ
Ⅱ 
A.装置Ⅰ在反应过程中只生成NO2气体
B.装置Ⅱ在开始阶段铁丝只发生析氢腐蚀
C.装置Ⅱ在反应过程中能产生氢气
D.装置Ⅰ在反应结束时溶液中的金属阳离子只有Cu2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用如图所示的装置制备乙酸乙酯,回答下列相关问题:
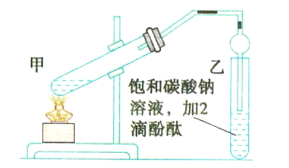
(1)连接好装置后,在加入试剂之前需要进行的操作是_________________________。
(2)甲试管中需加入少量____________以防止暴沸。
(3)浓硫酸在反应中的作用是________________________________。
(4)甲试管中发生反应的化学方程式为_______________________________。
(5)乙中球形管的作用是________________________________________。
(6)上述实验中饱和碳酸钠溶液的作用是___________(填序号)。
A.中和乙酸和乙醇
B.中和乙酸并吸收部分乙醇
C.乙酸乙酯在饱和碳酸钠溶液中的溶解度比在水中的溶解度小,有利于分层析出
(7)欲将乙中的物质分离得到乙酸乙酯,采取的实验方法是___________;分离时,乙酸乙酯应该从仪器的__________________(填“下口放出”或“上口倒出”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电化学原理被广泛地应用于生产、生活的许多方面。
I.制备氯气
工业中用电解饱和食盐水的方法制备氯气,其原理如下图所示。

(1)此过程中能量转化形式为_____转化为_____(填“化学能”或“电能”)
(2)电极乙为_____(填“阴极”或“阳极”),A 口生成的气体是_____
(3)电解饱和食盐水的离子方程式是 _____
(4)下列有关氯气的说法中正确的是_____
a.实验室常用排饱和食盐水法收集
b.可使碘化钾溶液变蓝
c.转化为 NaClO、ClO2 等含氯化合物可用于杀菌消毒
II.金属防护
某小组同学为探究电极对金属腐蚀与防护的影响,设计如下实验:将饱和食盐水与琼脂(凝固剂,不参与反应)的混合液置于两个培养皿中,向其中滴入少量酚酞溶液和K3Fe(CN)6溶液,混合均匀。分别将包裹锌片和铜片的铁钉放入两个培养皿中,观察现象如下。

(5)被腐蚀的是包裹_____的铁钉(填“锌片”或“铜片”)
(6)结合电极反应式解释 i 中现象产生的原因_____
(7)结合以上实验,请对铁制零件的使用提出建议_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产、生活、社会密切相关,请根据学过化学知识解答下列问题
(1)由下列物质冶炼相应金属时采用电解法的是___________。
a.Cu2S b.NaCl c.Fe2O3 d.HgS
(2) 银针验毒”在我国有上千年历史,银针主要用于检验是否有含硫元素的有毒物质。其反应原理之一为:4Ag+2H2S+O2=2Ag2S+2H2O。当银针变色后,将其置于盛有食盐水的铝制容器中一段时间后便可复原。原理是形成了原电池,该原电池的负极反应物为:______。
(3)某同学设计一个燃料电池(如下图所示),目的是探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜。
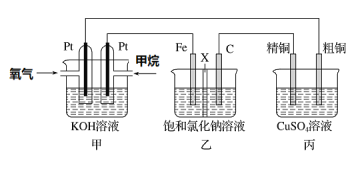
①通入甲烷的电极为________(填“正极”或“负极”),该电极反应式为___________。
②乙装置工作一段时间后,结合化学用语解释铁电极附近滴入酚酞变红的原因:____________。
③如果粗铜中含有锌、银等杂质,丙装置中反应一段时间,硫酸铜溶液浓度将________(填“增大”“减小”或“不变”)。精铜电极上的电极反应式为_________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com