
【题目】实验室用如图所示的装置制备乙酸乙酯,回答下列相关问题:
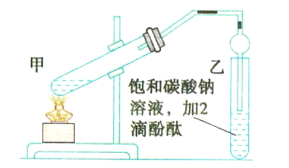
(1)连接好装置后,在加入试剂之前需要进行的操作是_________________________。
(2)甲试管中需加入少量____________以防止暴沸。
(3)浓硫酸在反应中的作用是________________________________。
(4)甲试管中发生反应的化学方程式为_______________________________。
(5)乙中球形管的作用是________________________________________。
(6)上述实验中饱和碳酸钠溶液的作用是___________(填序号)。
A.中和乙酸和乙醇
B.中和乙酸并吸收部分乙醇
C.乙酸乙酯在饱和碳酸钠溶液中的溶解度比在水中的溶解度小,有利于分层析出
(7)欲将乙中的物质分离得到乙酸乙酯,采取的实验方法是___________;分离时,乙酸乙酯应该从仪器的__________________(填“下口放出”或“上口倒出”)。
【答案】检验装置的气密性 碎瓷片(或沸石) 作催化剂和吸水剂 ![]() 防止倒吸 BC 分液 上口倒出
防止倒吸 BC 分液 上口倒出
【解析】
(1)连接好装置后,在加入试剂之前需要检验装置的气密性,故答案为:检验装置的气密性;
(2)甲试管中在浓硫酸作用下,乙醇和乙酸共热发生酯化反应生成乙酸乙酯和水,为防止加热过程中暴沸,应加入碎瓷片(或沸石)防止暴沸,故答案为:碎瓷片(或沸石);
(3)浓硫酸在反应中起催化剂的作用,可以加快化学反应速率;该反应为可逆反应,浓硫酸可以吸收生成的水,使酯化反应向生成乙酸乙酯的方向进行,提高乙酸乙酯的产率,故答案为:作催化剂和吸水剂;
(4)在浓硫酸作用下,乙醇和乙酸共热发生酯化反应生成乙酸乙酯和水,反应的化学方程式为![]() ,故答案为:
,故答案为:![]() ;
;
(5)乙酸乙酯中混有乙醇和乙酸,二者均易溶于水,乙中球形管可防止倒吸,故答案为:防止倒吸;
(6)乙中的饱和碳酸钠溶液能够中和挥发出来的乙酸,使之转化为乙酸钠溶于水中;能够溶解挥发出来的乙醇;能够降低乙酸乙酯在水中的溶解度,便于分层得到酯,则B、C项正确,故答案为:BC;
(7)乙酸乙酯不溶于水,可用分液的方法将乙中的混合液分离得到乙酸乙酯,因乙酸乙酯的密度小于水,分液时,下层水溶液从下口流出后,为防止发生污染,再将乙酸乙酯从分液漏斗的上口倒出,故答案为:分液;上口倒出。


科目:高中化学 来源: 题型:
【题目】NH3催化还原NO是重要的烟气脱硝技术,其反应过程与能量关系如图;研究发现在以Fe2O3为主的催化剂上可能发生的反应过程如图.下列说法正确的是 ( )
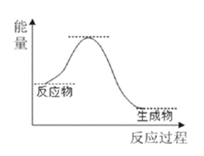

A.NH3催化还原NO为吸热反应
B.过程Ⅰ中NH3断裂非极性键
C.过程Ⅱ中NO为氧化剂,Fe2+为还原剂
D.脱硝的总反应为: 4NH3(g)+4NO(g)+ O2(g) ![]() 4N2(g)+6H2O(g)
4N2(g)+6H2O(g)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温时,将0.1 mol Fe(NO3)3和2 mol HCl溶于水得到2L混合溶液,然后向该溶液中投入m g铁粉,充分反应后,滴加KSCN溶液不变红色。下列有关说法正确的是
A.由于氧化性:Fe3+>H+,故首先发生的反应是Fe+2Fe3+=3Fe2+
B.充分反应后,共消耗56 g铁
C.m=28时,溶液剩余0.9 mol H+
D.当加入16.8 g铁粉时,可生成标准状况下6.72 L气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CH4-CO2催化重整可以得到合成气(CO和H2),有利于减小温室效应,其主要反应为CH4(g)+CO2(g)2CO(g)+2H2(g) ΔH=+247 kJ·mol1,同时存在以下反应:积碳反应:CH4(g)C(s)+2H2(g) ΔH=+75 kJ·mol1,消碳反应:CO2(g)+C(s)2CO(g) ΔH=+172 kJ·mol1,积碳会影响催化剂的活性,一定时间内积碳量和反应温度的关系如图。下列说法正确的是

A.高压利于提高 CH4 的平衡转化率并减少积碳
B.增大CO2与CH4的物质的量之比有助于减少积碳
C.升高温度,积碳反应的化学平衡常数K减小,消碳反应的K增大
D.温度高于600℃,积碳反应的化学反应速率减慢,消碳反应的化学反应速率加快, 积碳量减少
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据要求,写出下列反应的化学方程式(电解池中的电极均为惰性电极):
(1) 锌铜原电池(稀硫酸作电解质溶液)的电池反应____________________________________________
(2) 甲醇-空气电池(KOH溶液作电解质溶液)的总反应_______________________________________
(3) 电解硫酸铜溶液的总反应_____________________________________________________________
(4) 电解饱和食盐水(氯碱工业)的总反应____________________________________________________
(5) 实验室制氨气_______________________________________________________________________
(6)工业合成氨_________________________________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】探究浓度对2Fe3+ + 2I-2Fe2+ + I2 的影响,进行如下实验:

下列说法不正确的是
A.Ⅱ中加入的 SCN-结合Fe3+使平衡向左移动
B.Ⅲ中含有 I2
C.比较水溶液中的 c(I-):II>Ⅳ
D.比较水溶液中的 c(Fe3+):Ⅳ>I
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,盐酸只作氧化剂的是( )
A.Zn+2HCl = ZnCl2+H2↑B.MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
C.Cl2+H2O = H++Cl–+HClOD.CaCO3+2HCl=CaCl2+CO2↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,根据A~H在元素周期表中的位置,用元素符号或化学式回答下列问题:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
1 | A | |||||||
2 | D | E | G | |||||
3 | B | C | F | H |
(1)上表中,元素金属性最强的是________(填元素符号)。
(2)写出D的原子结构示意图:__________
(3)B与C的原子半径比较: ________C (填“>”或“<”)。G与H的非金属性比较:G ________ H(填“>”或“<”)。
(4)A与H形成化合物的电子式:_______
(5)写出B的最高价氧化物对应水化物与H的气态氢化物的水溶液反应的离子方程式:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在水溶液中1 mol ![]() 的能量(kJ)相对大小如下图所示。下列有关说法错误的是
的能量(kJ)相对大小如下图所示。下列有关说法错误的是

A. 上述离子中结合![]() 能力最强的是E
能力最强的是E
B. 上述离子中最稳定的是A
C. 上述离子与![]() 结合有漂白性的是B
结合有漂白性的是B
D. ![]() 反应物的键能之和小于生成物的键能之和
反应物的键能之和小于生成物的键能之和
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com