
【题目】探究浓度对2Fe3+ + 2I-2Fe2+ + I2 的影响,进行如下实验:

下列说法不正确的是
A.Ⅱ中加入的 SCN-结合Fe3+使平衡向左移动
B.Ⅲ中含有 I2
C.比较水溶液中的 c(I-):II>Ⅳ
D.比较水溶液中的 c(Fe3+):Ⅳ>I
【答案】D
【解析】
实验目的是探究浓度对平衡的影响,Ⅰ中发生反应2Fe3+ + 2I-2Fe2+ + I2并达到化学平衡,Ⅱ中加入饱和KSCN溶液,KSCN结合Fe3+使Fe3+浓度减小,平衡往左向移动,从而I2的量减小,故Ⅲ中萃取出来的I2较少,颜色较浅。
A. Ⅱ中加入的SCN-结合Fe3+,Fe3+浓度减小,平衡向左移动,A正确;
B. Ⅲ中CCl4萃取出来的液体显极浅的紫色,说明含有少量的I2,B正确;
C. II中加入饱和KSCN溶液,KSCN结合Fe3+使Fe3+浓度减小,平衡往左向移动,c(I-)相较于Ⅰ增大,Ⅳ中加入CCl4萃取I2,则水溶液中I2的量减少,平衡向右移动,c(I-)相较于Ⅰ减小,故水溶液中的 c(I-):II>Ⅳ,C正确;
D. Ⅳ中加入CCl4萃取I2,则水溶液中I2的量减少,平衡向右移动,c(Fe3+)相较于Ⅰ减小,故水溶液中的 c(Fe3+):Ⅳ<I,D错误;
答案选D。


科目:高中化学 来源: 题型:
【题目】Ⅰ.某烷烃![]() 与烯烃
与烯烃![]() 的混合气体
的混合气体![]() ,其密度为同状况下
,其密度为同状况下![]() 密度的11.2倍,将混合气体通过足量的溴水,溴水增重
密度的11.2倍,将混合气体通过足量的溴水,溴水增重![]() ,回答下列问题:
,回答下列问题:
(1)写出结构简式:![]() ________,
________,![]() ________。
________。
(2)![]() 与丁烯互为________(填“同分异构体”或“同系物”)。
与丁烯互为________(填“同分异构体”或“同系物”)。
(3)写出![]() 与溴水反应的化学方程式:________________。
与溴水反应的化学方程式:________________。
(4)下列有关![]() 的结构或性质的说法正确的是________(填序号)。
的结构或性质的说法正确的是________(填序号)。
A 不能使酸性高锰酸钾溶液褪色,但能使溴的四氯化碳溶液褪色
B 分子中所有原子都在同一平面上
C 分子中有7个单键
D 与![]() 在一定条件下能加成并只得到一种产物
在一定条件下能加成并只得到一种产物
Ⅱ.(5)已知甲苯(![]() )能使酸性
)能使酸性![]() 溶液褪色。某有机物的结构简式为
溶液褪色。某有机物的结构简式为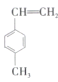 ,下列说法正确的是________(填序号)。
,下列说法正确的是________(填序号)。
A 该有机物使溴水褪色和在催化剂作用下与液溴反应原理一样
B 能用酸性![]() 溶液判断分子中存在碳碳双键
溶液判断分子中存在碳碳双键
C 该有机物在一定条件下与浓硝酸发生反应生成的苯环上的一硝基取代物可能有3种
D ![]() 该有机物在一定条件下最多与
该有机物在一定条件下最多与![]() 发生加成反应
发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组同学为探究同周期元素性质的递变规律,设计了如下实验。
(1)将等质量的钠、镁、铝分别投入到足量的相同浓度的盐酸中,试预测实验结果:上述金属中___(填化学式,下同)与盐酸反应最剧烈,___与盐酸反应生成的气体最多。
(2)向Na2S溶液中通入氯气出现淡黄色浑浊现象,可证明S、Cl元素非金属性强弱顺序为___,反应的离子方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,两套实验装置中进行的实验都涉及金属的腐蚀,假设其中的金属块和金属丝都是足量的。下列叙述正确的是( )
Ⅰ Ⅱ
Ⅱ 
A.装置Ⅰ在反应过程中只生成NO2气体
B.装置Ⅱ在开始阶段铁丝只发生析氢腐蚀
C.装置Ⅱ在反应过程中能产生氢气
D.装置Ⅰ在反应结束时溶液中的金属阳离子只有Cu2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用如图所示的装置制备乙酸乙酯,回答下列相关问题:
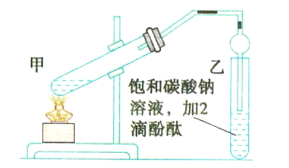
(1)连接好装置后,在加入试剂之前需要进行的操作是_________________________。
(2)甲试管中需加入少量____________以防止暴沸。
(3)浓硫酸在反应中的作用是________________________________。
(4)甲试管中发生反应的化学方程式为_______________________________。
(5)乙中球形管的作用是________________________________________。
(6)上述实验中饱和碳酸钠溶液的作用是___________(填序号)。
A.中和乙酸和乙醇
B.中和乙酸并吸收部分乙醇
C.乙酸乙酯在饱和碳酸钠溶液中的溶解度比在水中的溶解度小,有利于分层析出
(7)欲将乙中的物质分离得到乙酸乙酯,采取的实验方法是___________;分离时,乙酸乙酯应该从仪器的__________________(填“下口放出”或“上口倒出”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】偏二甲肼(C2H8N2)与 N2O4 是常用的火箭推进剂,常温下,1mol 液态 C2H8N2与 2mol 液态 N2O4 完全反应,生成 CO2、N2、H2O 三种无污染气体的同时释放出高达 2250kJ 的热量。
(1)偏二甲肼与 N2O4 反应的热化学方程式为_____
(2)反应中的氧化剂是_____
(3)火箭发射时常出现红棕色气体,原因为:N2O42NO2 当温度升高时,气体颜色变深,则该反应为_____热反应(填“吸”或“放”)
(4)现将 1mol N2O4 充入一个恒容密闭容器中,下列示意图正确且能说明 N2O42NO2达到平衡状态的是_____(填字母)

(5)在研究之初,科学家曾考虑将氧化性更强的F2或反应速率极快、释放能量更高的N5 用作推进剂,但综合分析后均未采用,请分析火箭推进剂应具备的特点是_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电化学原理被广泛地应用于生产、生活的许多方面。
I.制备氯气
工业中用电解饱和食盐水的方法制备氯气,其原理如下图所示。

(1)此过程中能量转化形式为_____转化为_____(填“化学能”或“电能”)
(2)电极乙为_____(填“阴极”或“阳极”),A 口生成的气体是_____
(3)电解饱和食盐水的离子方程式是 _____
(4)下列有关氯气的说法中正确的是_____
a.实验室常用排饱和食盐水法收集
b.可使碘化钾溶液变蓝
c.转化为 NaClO、ClO2 等含氯化合物可用于杀菌消毒
II.金属防护
某小组同学为探究电极对金属腐蚀与防护的影响,设计如下实验:将饱和食盐水与琼脂(凝固剂,不参与反应)的混合液置于两个培养皿中,向其中滴入少量酚酞溶液和K3Fe(CN)6溶液,混合均匀。分别将包裹锌片和铜片的铁钉放入两个培养皿中,观察现象如下。

(5)被腐蚀的是包裹_____的铁钉(填“锌片”或“铜片”)
(6)结合电极反应式解释 i 中现象产生的原因_____
(7)结合以上实验,请对铁制零件的使用提出建议_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】解释下列事实所用的方程式不正确的是( )
A.碳酸氢钠在水溶液中的电离:NaHCO3=Na++HCO![]()
B.硫酸酸化的KI淀粉溶液久置后变蓝:4I-+O2 + 4H+ = 2I2+2H2O
C.用热的纯碱溶液清洗油污:CO![]() + 2H2OH2CO3 + 2OH-
+ 2H2OH2CO3 + 2OH-
D.用Na2CO3溶液处理锅炉水垢中的硫酸钙:CO![]() + CaSO4 =CaCO3 + SO
+ CaSO4 =CaCO3 + SO![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列用于解释事实的方程式书写不正确的是
A.0.1mol/L氨水的pH约为11.1:NH3·H2O![]() NH4++OH-
NH4++OH-
B.用明矾 [KAl(SO4)2·12H2O]作净水剂:Al3++3H2O![]() Al(OH)3(胶体)+3H+
Al(OH)3(胶体)+3H+
C.用饱和Na2CO3溶液处理水垢中的CaSO4(微溶):Ca2++CO32-=CaCO3↓
D.向K2Cr2O7溶液中滴加少量浓H2SO4,溶液橙色加深:![]() (橙色)+H2O
(橙色)+H2O![]() 2CrO42-(黄色)+2H+
2CrO42-(黄色)+2H+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com