
【题目】解释下列事实所用的方程式不正确的是( )
A.碳酸氢钠在水溶液中的电离:NaHCO3=Na++HCO![]()
B.硫酸酸化的KI淀粉溶液久置后变蓝:4I-+O2 + 4H+ = 2I2+2H2O
C.用热的纯碱溶液清洗油污:CO![]() + 2H2OH2CO3 + 2OH-
+ 2H2OH2CO3 + 2OH-
D.用Na2CO3溶液处理锅炉水垢中的硫酸钙:CO![]() + CaSO4 =CaCO3 + SO
+ CaSO4 =CaCO3 + SO![]()
 教学练新同步练习系列答案
教学练新同步练习系列答案 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案科目:高中化学 来源: 题型:
【题目】水溶液X中只可能溶有K+、Mg2+、Al3+、![]() 、
、![]() 、
、![]() 、
、![]() 中的若干种离子。某同学对该溶有进行了如下实验:
中的若干种离子。某同学对该溶有进行了如下实验:

下列判断正确的是
A.气体甲一定是纯净物
B.沉淀甲是硅酸和硅酸镁的混合物
C.K+、![]() 和
和![]() 一定存在于溶液X中
一定存在于溶液X中
D.![]() 和
和![]() 一定不存在于溶液X中
一定不存在于溶液X中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】探究浓度对2Fe3+ + 2I-2Fe2+ + I2 的影响,进行如下实验:

下列说法不正确的是
A.Ⅱ中加入的 SCN-结合Fe3+使平衡向左移动
B.Ⅲ中含有 I2
C.比较水溶液中的 c(I-):II>Ⅳ
D.比较水溶液中的 c(Fe3+):Ⅳ>I
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外学习小组对日常生活中不可缺少的调味品M进行探究。已知C可在D中燃烧发出苍白色火焰。M与其他物质的转化关系如下图所示(部分产物、反应条件已略去):

(1)常温下,用惰性电极电解M溶液(足量)发生反应的离子方程式为__________,电解一段时间后,让溶液复原的方法为_____ ,若M溶液为0.5 L,电解一段时间后,两极共生成气体1.12 L(已折算为标准状况下的体积),则电解后溶液的pH为_____(忽略溶液的体积变化)。
(2)若A是一种常见的难溶于水的酸性氧化物,可用于制造玻璃,则E溶液的俗称是_______。
(3)若A是CO2气体,将一定量的A通入B溶液,得到溶液W,再向溶液W中滴入盐酸,相关量如图所示,则溶液W中的溶质及其物质的量分别为_____、_____。

(4)若A是一种化肥。A和B反应可生成气体E,E与D相遇产生白烟,工业上可利用E与D的反应检查输送D的管道是否泄漏,是因为E与D可发生反应:_________(写化学方程式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,根据A~H在元素周期表中的位置,用元素符号或化学式回答下列问题:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
1 | A | |||||||
2 | D | E | G | |||||
3 | B | C | F | H |
(1)上表中,元素金属性最强的是________(填元素符号)。
(2)写出D的原子结构示意图:__________
(3)B与C的原子半径比较: ________C (填“>”或“<”)。G与H的非金属性比较:G ________ H(填“>”或“<”)。
(4)A与H形成化合物的电子式:_______
(5)写出B的最高价氧化物对应水化物与H的气态氢化物的水溶液反应的离子方程式:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①从石油中获得是目前工业上生产A的主要途径,A的产量通常用来衡量一个国家的石油化工发展水平;②2CH3CHO+O2![]() 2CH3COOH。现以A为主要原料合成乙酸乙酯,其合成路线如下图所示。
2CH3COOH。现以A为主要原料合成乙酸乙酯,其合成路线如下图所示。

回答下列问题:
(1)写出A的结构简式______________________________。
(2)B、D分子中的官能团名称分别是________、________。
(3)写出下列反应的反应类型:①________,②________。
(4)写出反应④的化学方程式:________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】营养平衡与人体健康:
(1)营养均衡有利于身体健康。秋葵是一种大众喜爱的食材,含有蛋白质、维生素A、维生素C、纤维素、阿拉伯果糖和丰富的铁、锌、钙等元素,其中:

①属于糖类的有:阿拉伯果糖、___。
②蛋白质在人体内水解的最终产物为___。
③人体缺乏某种微量元素会发生贫血,这种微量元素是___。
④属于水溶性维生素的是___,缺乏该维生素会引起___。
(2)如图为某品牌酱油标签的一部分。

①氨基酸态氮的含量是酱油质量的重要指标,这些氨基酸是由大豆中的主要营养物质___水解而来。
②配料清单中属于防腐剂的是___。
③小麦中的主要营养物质是___。
(3)了解一些用药常识,有利于自我保健。现有下列药物:碳酸镁、青霉素、阿司匹林、氢氧化铝。
①其中属于解热镇痛的药物是___;
②青霉素作用是___。
③药片常用淀粉作为黏合剂,淀粉水解最终产物是___。
④某胃药的主要成分是AlaMgb(OH)cCO3。常用于冶疗胃酸过多,写出其与胃酸反应的化学方程式:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图所示装置探究Cl2和NO2在NaOH溶液中的反应,若通入适当比例的Cl2和NO2,即发生反应Cl2+2NO2+4NaOH=2NaNO3+2NaCl+2H2O。
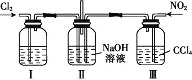
下列叙述正确的是
A. 实验室中用二氧化锰与3 mol·L-1的盐酸共热制备氯气
B. 装置Ⅰ中盛放的试剂是浓硫酸,作用是干燥氯气
C. 装置Ⅲ的作用是便于控制通入NO2的量
D. 若制备的NO2中含有NO,应将混合气体通入水中以除去NO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上常利用含硫废水生产Na2S2O35H2O,实验室可用如下装置(略去部分加持仪器)模拟生成过程。
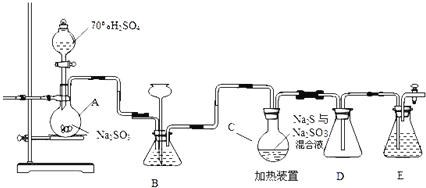
烧瓶C中发生反应如下:
Na2S(aq)+H2O(l)+SO2(g)=Na2SO3(aq)+H2S(aq) (Ⅰ)
2H2S(aq)+SO2(g)=3S(s)+2H2O(l) (Ⅱ)
S(s)+Na2SO3(aq)![]() Na2S2O3(aq) (Ⅲ)
Na2S2O3(aq) (Ⅲ)
(1)装置A中发生的化学反应方程式为 ______
(2)为提高产品纯度,应使烧瓶C中Na2S和Na2SO3恰好完全反应,则烧瓶C中Na2S和Na2SO3物质的量之比为 ______ 。
(3)装置B的作用之一是观察SO2的生成速率,其中的液体最好选择 ______
a.蒸馏水 b.饱和Na2SO3溶液 c.饱和NaHSO3溶液 d.饱和NaHCO3溶液
实验中,为使SO2缓慢进入烧瓶C,采用的操作是 ______ 。
(4)已知反应(Ⅲ)相对较慢,则烧瓶C中反应达到终点的现象是 ______ ,装置E的作用为 ______
(5)反应终止后,烧瓶C中的溶液经蒸发浓缩即可析出Na2S2O35H2O,其中可能含有Na2SO3、Na2SO4等杂质,利用所给试剂设计实验,检测产品中是否存在Na2SO4,简要说明实验操作,现象和结论: ______ 。
已知:Na2S2O35H2O遇酸易分解:S2O32+2H+=S↓+SO2↑+H2O,供选择的试剂:稀盐酸、稀硫酸、稀硝酸、BaCl2溶液、AgNO3溶液。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com