
【题目】根据要求,写出下列反应的化学方程式(电解池中的电极均为惰性电极):
(1) 锌铜原电池(稀硫酸作电解质溶液)的电池反应____________________________________________
(2) 甲醇-空气电池(KOH溶液作电解质溶液)的总反应_______________________________________
(3) 电解硫酸铜溶液的总反应_____________________________________________________________
(4) 电解饱和食盐水(氯碱工业)的总反应____________________________________________________
(5) 实验室制氨气_______________________________________________________________________
(6)工业合成氨_________________________________________________________________________
【答案】Zn+2H2SO4=ZnSO4+H2↑ 2CH3OH+3O2+4KOH=2K2CO3+6H2O 2CuSO4+2H2O![]() 2Cu+O2↑+2H2SO4 2NaCl+2H2O
2Cu+O2↑+2H2SO4 2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑ Ca(OH)2+2NH4Cl
2NaOH+H2↑+Cl2↑ Ca(OH)2+2NH4Cl![]() CaCl2+2NH3↑+2H2O N2+3H2
CaCl2+2NH3↑+2H2O N2+3H2![]() 2NH3
2NH3
【解析】
(1) 锌铜原电池(稀硫酸作电解质溶液)中,锌作负极,失电子生成Zn2+进入溶液,稀硫酸中的H+得电子生成H2;
(2) 甲醇-空气电池(KOH溶液作电解质溶液),负极甲醇失电子,并与电解质中的OH-作用,最终生成CO32-和水,正极的O2得电子,并与电解质中的水结合生成OH-;
(3) 电解硫酸铜溶液,铜离子在阴极得电子生成铜,附着在阴极表面,电解质溶液中的水在阳极失电子,生成氧气和H+;
(4) 电解饱和食盐水(氯碱工业),Cl-在阳极失电子生成Cl2,水在阴极得电子生成H2和OH-;
(5) 实验室制氨气,用氯化铵与氢氧化钙共热发生反应,生成氯化钙、氨气和水;
(6)工业合成氨,利用氮气与氢气在高温、高压、催化剂作用下发生反应。
(1) 锌铜原电池(稀硫酸作电解质溶液)中,锌作负极,失电子生成Zn2+进入溶液,稀硫酸中的H+得电子生成H2,最终生成硫酸锌和氢气,发生反应的化学方程式为Zn+2H2SO4=ZnSO4+H2↑;答案为:Zn+2H2SO4=ZnSO4+H2↑;
(2) 甲醇-空气电池(KOH溶液作电解质溶液),负极甲醇失电子,并与电解质中的OH-作用,生成CO32-和水,正极的O2得电子,并与电解质中的水结合生成OH-,最终生成碳酸钾和水,发生反应的化学方程式为2CH3OH+3O2+4KOH=2K2CO3+6H2O;答案为:2CH3OH+3O2+4KOH=2K2CO3+6H2O;
(3) 电解硫酸铜溶液,铜离子在阴极得电子生成铜,附着在阴极表面,电解质溶液中的水在阳极失电子,生成氧气和H+,最终生成铜、氧气和硫酸,发生反应的化学方程式为2CuSO4+2H2O![]() 2Cu+O2↑+2H2SO4;答案为:2CuSO4+2H2O
2Cu+O2↑+2H2SO4;答案为:2CuSO4+2H2O![]() 2Cu+O2↑+2H2SO4;
2Cu+O2↑+2H2SO4;
(4) 电解饱和食盐水(氯碱工业),Cl-在阳极失电子生成Cl2,水在阴极得电子生成H2和OH-,最终生成氢氧化钠、氢气和氯气,发生反应的化学方程式为2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑;答案为:2NaCl+2H2O
2NaOH+H2↑+Cl2↑;答案为:2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑;
2NaOH+H2↑+Cl2↑;
(5) 实验室制氨气,用氯化铵与氢氧化钙共热发生反应,生成氯化钙、氨气和水,发生反应的化学方程式为Ca(OH)2+2NH4Cl![]() CaCl2+2NH3↑+2H2O;答案为:Ca(OH)2+2NH4Cl
CaCl2+2NH3↑+2H2O;答案为:Ca(OH)2+2NH4Cl![]() CaCl2+2NH3↑+2H2O;
CaCl2+2NH3↑+2H2O;
(6)工业合成氨,利用氮气与氢气在高温、高压、催化剂作用下发生反应,反应的化学方程式为N2+3H2![]() 2NH3。答案为:N2+3H2
2NH3。答案为:N2+3H2![]() 2NH3。
2NH3。


 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:
【题目】某离子反应中涉及![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 六种微粒,其中
六种微粒,其中![]() 的物质的量随时间变化的曲线如图所示。下列判断正确的是
的物质的量随时间变化的曲线如图所示。下列判断正确的是
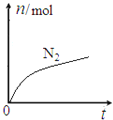
A. 该反应的氧化剂ClO-,还原产物是![]() B. 消耗1mol还原剂,转移6mol电子
B. 消耗1mol还原剂,转移6mol电子
C. 水是生成物,且反应后溶液的酸性明显增强 D. 氧化剂与还原剂的物质的量之比为2:3
查看答案和解析>>
科目:高中化学 来源: 题型:
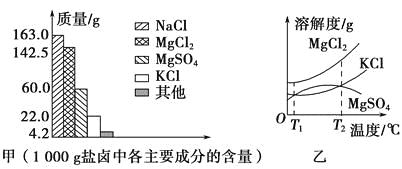
【题目】我国拥有很长的海岸线,具有丰富的海洋资源,以海水为原料的盐化工是我国重要的产业。盐卤是海水晒盐后的富含镁盐的溶液,其中除含镁盐外,还含有其他盐类(如下图甲)。盐卤在食品、化工等方面具有广泛的用途。请解答下列与盐卤有关的试题。
(1)根据图甲,写出盐卤中含量最多的两种盐的化学式:_______、_______。
(2)下图乙是盐卤中某些物质的溶解度曲线,已知T1℃时,MgSO4和KCl的溶解度分别为M、N,则它们溶解度大小的关系为_______;将盐卤加热到T2℃以上,根据溶解度曲线,首先从盐卤中分离出来的晶体是______________________________________________________。
(3)化工厂利用卤水生产金属镁的工艺流程如下:
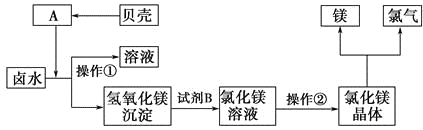
“操作①”的目的是将氢氧化镁沉淀分离出来,操作①的名称是_______。氢氧化镁与试剂B反应的化学方程式为______________________________。
操作②的名称是_______。该方法的优点为___________________________。
(4)用电解法制备金属镁,两位同学分别设计了下面的两种方法。
甲:电解氯化镁溶液。
乙:电解熔融的氯化镁。
其中同学_______(填“甲”或“乙”)能够成功地制备金属镁,假设生产过程中镁元素没有损失,则100 g卤水可制备镁_______g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1) 写出CO2的空间构型:___________。
(2) 写出Na3N的电子式:____________________。
(3) 写出C2H6O的化学名称:______________________。
(4) 写出乙烯的实验式:_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图所示装置进行下列实验,能得出相应实验结论的是
选项 | ① | ② | ③ | 实验结论 |
|
A | 浓盐酸 | KMnO4 | NaOH | 能制取、收集氯气并能吸收尾气 | |
B | 浓氨水 | 生石灰 | 酚酞稀溶液 | 能制取氨气并验证氨气的水溶液呈碱性 | |
C | 稀盐酸 | Na2SO3 | Ba(NO3)2溶液 | SO2与可溶性钡盐均可生成白色沉淀 | |
D | 稀硫酸 | Na2CO3 | Na2SiO3溶液 | 非金属性:S>C>Si |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用如图所示的装置制备乙酸乙酯,回答下列相关问题:
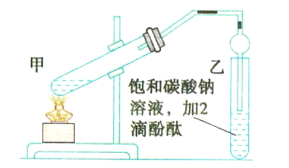
(1)连接好装置后,在加入试剂之前需要进行的操作是_________________________。
(2)甲试管中需加入少量____________以防止暴沸。
(3)浓硫酸在反应中的作用是________________________________。
(4)甲试管中发生反应的化学方程式为_______________________________。
(5)乙中球形管的作用是________________________________________。
(6)上述实验中饱和碳酸钠溶液的作用是___________(填序号)。
A.中和乙酸和乙醇
B.中和乙酸并吸收部分乙醇
C.乙酸乙酯在饱和碳酸钠溶液中的溶解度比在水中的溶解度小,有利于分层析出
(7)欲将乙中的物质分离得到乙酸乙酯,采取的实验方法是___________;分离时,乙酸乙酯应该从仪器的__________________(填“下口放出”或“上口倒出”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用下图流程可制备1,4-环己二醇,试回答:
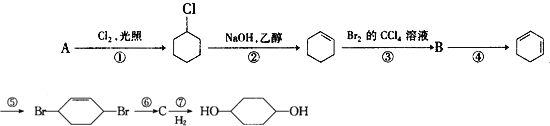
(1)反应①、②、③分别属于___、____、___。(填反应类型)
(2)化合物![]() 中所含官能团的名称为_______和________。
中所含官能团的名称为_______和________。
(3)写出下列化合物的结构简式:A_________,C________。
(4)反应④所用的试剂和条件为_________________。
(5)写出下列反应的化学方程式:反应①_____________;反应④_______________。
(6)请写出以CH3CH2Br为原料制备HOCH2CH2OH的合成路线流程图[无机试剂任用,合成路线流程图示例见本题]。________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业合成氨技术反应原理为:N2 (g)+3H2(g)2NH3(g) ΔH=-92.4 kJ·mol-1
(1)T ℃ 时,反应达到平衡,测得 υ(NH3)=0.12 mol·L-1·min -1
① υ(N2)=____mol·L-1·min -1
② 化学平衡常数表达式 K=_____
(2)在其他条件相同时,图为分别测定不同压强、不同温度下,N2 的平衡转化率。

L 表示______,其中 X1______ X2(填“>”或“<)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以电石渣[主要成分为Ca(OH)2和CaCO3]为原料制备KClO3的流程如下:

下列说法正确的是
A.打浆步骤,将电石渣配制成溶液
B.氯化步骤,发生的主要反应2Ca(OH)2 + 2Cl2 = Ca(ClO)2 + CaCl2 +2H2O
C.氯化过程加快氯气的通入速率,有利于提高KClO3的产率
D.KClO3晶体中可能混有 KCl、KClO等杂质
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com