
【题目】利用下图流程可制备1,4-环己二醇,试回答:
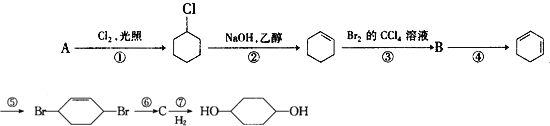
(1)反应①、②、③分别属于___、____、___。(填反应类型)
(2)化合物![]() 中所含官能团的名称为_______和________。
中所含官能团的名称为_______和________。
(3)写出下列化合物的结构简式:A_________,C________。
(4)反应④所用的试剂和条件为_________________。
(5)写出下列反应的化学方程式:反应①_____________;反应④_______________。
(6)请写出以CH3CH2Br为原料制备HOCH2CH2OH的合成路线流程图[无机试剂任用,合成路线流程图示例见本题]。________。
【答案】取代反应 消去反应 加成反应 碳碳双键 溴原子 ![]()
![]() 氢氧化钠、乙醇、加热
氢氧化钠、乙醇、加热 ![]()
![]() CH3CH2Br
CH3CH2Br![]() CH2=CH2
CH2=CH2![]() BrCH2CH2Br
BrCH2CH2Br![]() HOCH2CH2OH,故答案为:CH3CH2Br
HOCH2CH2OH,故答案为:CH3CH2Br![]() CH2=CH2
CH2=CH2![]() BrCH2CH2Br
BrCH2CH2Br![]() HOCH2CH2OH
HOCH2CH2OH
【解析】
A和氯气在光照条件下发生取代反应生成![]() ,则A为环己烷,
,则A为环己烷,![]() 在氢氧化钠的醇溶液、加热条件下发生消去反应生成
在氢氧化钠的醇溶液、加热条件下发生消去反应生成![]() ,
,![]() 和溴的四氯化碳发生加成反应得到B,B发生消去反应生成
和溴的四氯化碳发生加成反应得到B,B发生消去反应生成![]() ,所以B的结构简式为
,所以B的结构简式为![]() ,
,![]() 和溴发生1,4-加成反应生成
和溴发生1,4-加成反应生成![]() ,
,![]() 在氢氧化钠的水溶液、加热条件下发生取代反应生成C为
在氢氧化钠的水溶液、加热条件下发生取代反应生成C为![]() ,
,![]() 和氢气发生加成反应生成
和氢气发生加成反应生成![]() 。
。
⑴根据上面分析得出反应①是取代反应,反应②是消去反应,反应③是加成反应,故答案为:取代反应;消去反应;加成反应;
⑵化合物![]() 中所含官能团的名称为碳碳双键和溴原子,故答案为碳碳双键;溴原子;
中所含官能团的名称为碳碳双键和溴原子,故答案为碳碳双键;溴原子;
⑶A的结构简式为![]() ,C的结构简式为
,C的结构简式为![]() ,故答案为:
,故答案为:![]() ;
;![]() ;
;
⑷根据分析反应④为卤代烃的消去反应,因此所用的试剂和条件为氢氧化钠、乙醇、加热条件,故答案为氢氧化钠、乙醇、加热;
⑸反应①是取代反应,反应的化学方程式:![]() ,故答案为:
,故答案为:![]() ;
;
反应④是消去反应,反应的化学方程式是![]() ,故答案为:
,故答案为:![]() ;
;
⑹HOCH2CH2OH中羟基是卤代烃水解得到,即BrCH2CH2Br![]() HOCH2CH2OH,而BrCH2CH2Br通过加成反应得到,即CH2=CH2
HOCH2CH2OH,而BrCH2CH2Br通过加成反应得到,即CH2=CH2 ![]() BrCH2CH2Br,而CH2=CH2通过CH3CH2Br消去反应得到,即CH3CH2Br
BrCH2CH2Br,而CH2=CH2通过CH3CH2Br消去反应得到,即CH3CH2Br ![]() CH2=CH2,因此整个流程图为CH3CH2Br
CH2=CH2,因此整个流程图为CH3CH2Br![]() CH2=CH2
CH2=CH2![]() BrCH2CH2Br
BrCH2CH2Br![]() HOCH2CH2OH,故答案为:CH3CH2Br
HOCH2CH2OH,故答案为:CH3CH2Br![]() CH2=CH2
CH2=CH2![]() BrCH2CH2Br
BrCH2CH2Br![]() HOCH2CH2OH。
HOCH2CH2OH。


科目:高中化学 来源: 题型:
【题目】常温常压下,将下列各组气体分别充入到容积可变的密闭容器中,充分反应后,体积由大到小的顺序是
①2molNH3和1molHCl,②2molSO2和1molO2,③2molH2S和1molSO2,④2molNO和1molO2,⑤1molH2和1mol Cl2
A. ②>④>⑤>①>③
B. ②>⑤>④>①>③
C. ④>②=⑤>③>①
D. ④=⑤>②>③>①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌铜原电池装置如图所示,下列说法不正确的是

A.电子从锌片流向铜片
B.盐桥中 K+向负极移动
C.锌电极上发生的反应:Zn 2e- =Zn2+
D.该装置实现了氧化反应和还原反应分开进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据要求,写出下列反应的化学方程式(电解池中的电极均为惰性电极):
(1) 锌铜原电池(稀硫酸作电解质溶液)的电池反应____________________________________________
(2) 甲醇-空气电池(KOH溶液作电解质溶液)的总反应_______________________________________
(3) 电解硫酸铜溶液的总反应_____________________________________________________________
(4) 电解饱和食盐水(氯碱工业)的总反应____________________________________________________
(5) 实验室制氨气_______________________________________________________________________
(6)工业合成氨_________________________________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备乙酸乙酯的实验装置如图所示:
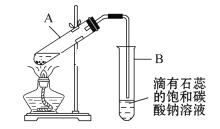
(1)A中浓硫酸的作用是________。
(2)实验时预计试管B中产生的现象有:___、___(答2点)。
(3)欲从试管B中分离出乙酸乙酯,采用的方法是_______(填操作名称);若要对产品乙酸乙酯进行干燥,__(填“能”或“不能”)用碱石灰干燥,理由是______。
(4)写出实验室用乙醇和乙酸制取乙酸乙酯的化学方程式:_______。
(5)若在A中加入4.6 g的乙醇、9.0 g的乙酸、数滴浓硫酸,缓慢加热A至充分反应,最后将产品进行纯化,得乙酸乙酯5.28 g,本实验的产率是________。备注:产率指的是某种生成物的实际产量与理论产量的比值。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,盐酸只作氧化剂的是( )
A.Zn+2HCl = ZnCl2+H2↑B.MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
C.Cl2+H2O = H++Cl–+HClOD.CaCO3+2HCl=CaCl2+CO2↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.汽车尾气是城市空气的污染源之一。治理的方法之一是在汽车的排气管上装一个“催化转换器”。它可以使CO与NO反应,生成可参与大气循环的无毒气体。
(1)下列与汽车尾气的排放密切相关的是___________(填序号)。
A.光化学烟雾 B.水体富营养化与赤潮
C.白色污染 D.雾霾
(2)写出一氧化碳与一氧化氮反应的化学方程式:________________
Ⅱ.减少交通事故除遵守交通法规正确驾驶外,安全措施也极为重要。汽车的安全气囊内有叠氮化钠(NaN) I 与硝酸钱(NH4NO3)等物质。当汽车在高速行驶中受到猛烈撞击时,这些物质会迅速发生分解反应,产生大量气体,充满气囊,从而保护驾驶员和乘客的安全。
(3)下列判断正确的是____________填序号)。
A.道路起雾与H2O分子中的化学键断裂有关
B.NH4NO3中只含有极性共价键
C.NaN3受到猛烈撞击时有化学键的断裂
D.NaN3、NH4NO3均属于离子化合物
(4)汽车的安全气囊内叠氮化钠爆炸过程中的能量变化如图所示:

①叠氮化钠的爆炸反应属于__________(填“吸热”或“放热”)反应。
②若上述爆炸过程中的能量变化为2(a-b)kJ,则消耗叠氮化钠的质量为 __________g。
③若安全气囊的体积为V L,NaN3的爆炸在ts内完成,反应过程中消耗292.5 g NaN3,则用N2表示的反应速率为____________mol L-1 s-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各种变化属于原电池反应的是( )
A.在空气中金属铝表面迅速氧化形成保护层
B.工业上用饱和的食盐水制备氯气和烧碱
C.锌与稀硫酸反应时,加入少量的硫酸铜溶液,可加快反应速率
D.铜在空气中加热变黑,趁热立即插入无水乙醇中又变红
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质转化在给定条件下能实现的是( )
①FeS2 ![]() SO3
SO3![]() H2SO4→CO2
H2SO4→CO2
②Al2O3![]() NaAlO2(aq)→Al(OH)3
NaAlO2(aq)→Al(OH)3
③NaCl(aq)![]() Na→NaOH(aq)
Na→NaOH(aq)
④Fe![]() FeSO4(aq)→Fe(OH)2
FeSO4(aq)→Fe(OH)2![]() Fe2O3
Fe2O3
⑤海水 ![]() 母液
母液 ![]() NaBrNaBrO3
NaBrNaBrO3![]() 粗溴
粗溴![]() Br2
Br2
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com