
【题目】为探究Fe3+和Cu2+对H2O2分解反应的催化效果,某同学分别设计了图1、图2所示的实验。下列叙述中不正确的是

A.图2中的A为分液漏斗
B.图2实验可通过测定相同状况下产生的气体体积与反应时间来比较反应速率
C.图1实验可通过观察产生气泡的快慢来比较反应速率
D.若图1实验中反应速率为①>②,则Fe3+对H2O2分解的催化效果一定比Cu2+好
科目:高中化学 来源: 题型:
【题目】根据题意请回答有关氮的氧化物和氢化物的问题:
(1)随着人类社会的发展,氮氧化物的排放导致一系列问题。NO形成硝酸型酸雨的化学方程式为_______。一定条件下,用甲烷可以消除氮的氧化物(NOx)的污染。已知:①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH1=-574.1 kJ·mol-1,
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH2=-1160.6 kJ·mol-1则CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) ΔH= ___________ 。
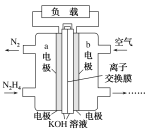
(2)肼(N2H4)可以用作燃料电池的原料。肼的电子式为_________,一种以液态肼为燃料的电池装置如图所示,该电池用空气中的氧气作为氧化剂,KOH溶液作为电解质溶液。b电极是_____极(填“正”或“负”),a电极的电极反应式:__________________。
(3)25 ℃时,Kb(NH3·H2O)=1.8×10-5 mol·L-1,向含a mol NH4NO3的溶液中滴加b L氨水呈中性,则所滴加氨水的浓度为___________。
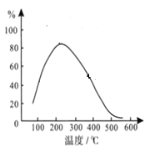
(4)在体积恒定的密闭容器中有可逆反应: 2NO(g)+O2(g) ![]() 2NO2(g) ΔH<0 ,NO和O2的起始浓度之比为2:1,反应经历相同时间,测得不同温度下NO转化为NO2的转化率如图,则150 ℃时,v(正)________v(逆)(填“>”或“<”)。
2NO2(g) ΔH<0 ,NO和O2的起始浓度之比为2:1,反应经历相同时间,测得不同温度下NO转化为NO2的转化率如图,则150 ℃时,v(正)________v(逆)(填“>”或“<”)。
(5)判断在恒温恒容条件下该反应已达到平衡状态的是_____
A 2v正(NO2)=v逆(O2) B 反应容器中压强不随时间变化而变化
C 混合气体颜色深浅保持不变 D 混合气体平均相对分子质量保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯酸镁![]() 常做催熟剂、除草剂等,实验室利用卤块制备少量
常做催熟剂、除草剂等,实验室利用卤块制备少量![]() ,已知:卤块的主要成分为
,已知:卤块的主要成分为![]() ,含有
,含有![]() 、
、![]() 等杂质。工艺流程如下:
等杂质。工艺流程如下:
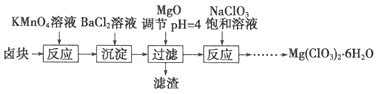
下列说法不正确的是![]()
A.可以用酸性![]() 溶液代替
溶液代替![]() 溶液
溶液
B.滤渣的主要成分是![]() 和
和![]()
C.加入![]() 饱和溶液发生了复分解反应
饱和溶液发生了复分解反应
D.调节溶液![]() ,还可以防止
,还可以防止![]() 结晶时
结晶时![]() 的水解
的水解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将4mol SO2(g)与2molO2(g)放入4L的密闭容器中,在一定条件下反应达到平衡:
2SO2(g)+ O2(g)![]() 2SO3(g) 测得平衡时混合物总的物质的量为5mol,求:
2SO3(g) 测得平衡时混合物总的物质的量为5mol,求:
(1)平衡时各物质的浓度;
(2)平衡时SO2的转化率。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2是一种国际公认的安全、无毒的绿色消毒剂,沸点11℃,凝固点-59℃。工业上,可用下列原理制备ClO2(液相反应):![]() 。设NA是阿伏伽德罗常数的值。下列说法正确的是( )
。设NA是阿伏伽德罗常数的值。下列说法正确的是( )
A.在标准状况下,2240mL ClO2含有原子数为0.3NA
B.若生成1.5mol Na2SO4,则反应后的溶液中Fe3+数目为0.2NA
C.48.0g FeS2完全反应,则上述反应中转移电子数为6NA
D.每消耗30mol NaClO3,生成的水中氢氧键数目为14NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应3A(g)+B(g)![]() 2C(g)+3D(g),下列各数据表示不同条件下的反应速率,其中反应进行得最快的是
2C(g)+3D(g),下列各数据表示不同条件下的反应速率,其中反应进行得最快的是
A.v(A)=0.9 mol·L-1·min-1B.v(B)=0.2mol·L-1·min-1
C.v(C)=0.5mol·L-1·min-1D.v(D)=1.0mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室从含碘废液![]() 含有
含有![]() 、
、![]() 、
、![]() 、
、![]() 等
等![]() 中回收碘,操作过程如下:
中回收碘,操作过程如下:

![]() 向废液中加入
向废液中加入![]() 溶液,发生“还原”反应的离子方程式为 ______。
溶液,发生“还原”反应的离子方程式为 ______。
![]() “氧化”操作在三颈烧瓶中进行,将溶液用盐酸调至pH约为2,缓慢通入
“氧化”操作在三颈烧瓶中进行,将溶液用盐酸调至pH约为2,缓慢通入![]() 。实验用水浴控制在
。实验用水浴控制在![]() 左右的较低温度下进行的原因是 ______。
左右的较低温度下进行的原因是 ______。

![]() 某研究小组用图装置对
某研究小组用图装置对![]() 与KI溶液的反应进行探究,发现通入
与KI溶液的反应进行探究,发现通入![]() 一段时间后,KI溶液变为黄色,继续通入
一段时间后,KI溶液变为黄色,继续通入![]() ,则溶液黄色变浅,最后变为无色.研究小组对所得无色溶液中碘元素的存在形态提出了以下假设:
,则溶液黄色变浅,最后变为无色.研究小组对所得无色溶液中碘元素的存在形态提出了以下假设:

假设一:没有![]() 形态;假设二:没有
形态;假设二:没有![]() 形态;假设三:有
形态;假设三:有![]() 形态。
形态。
![]() 请设计实验证明假设一成立
请设计实验证明假设一成立![]() 试剂自选
试剂自选![]() 。
。
实验操作 | 预期现象 | 结论 |
_______ | _______ | 假设一成立 |
![]() 若假设三成立,请写出生成
若假设三成立,请写出生成![]() 的离子方程式 ______。
的离子方程式 ______。
![]() 该研究小组还进行了对加碘盐中
该研究小组还进行了对加碘盐中![]() 含量测定的如下实验:
含量测定的如下实验:
![]() 准确称取加碘盐mg于烧杯中,加入适量蒸馏水和过量的KI,再滴入适量的稀硫酸,充分反应,将所得混合液配成
准确称取加碘盐mg于烧杯中,加入适量蒸馏水和过量的KI,再滴入适量的稀硫酸,充分反应,将所得混合液配成![]() 待测溶液.移取
待测溶液.移取![]() 待测溶液于锥形瓶中,加几滴淀粉试液,用c
待测溶液于锥形瓶中,加几滴淀粉试液,用c![]()
![]() 标准液滴定至终点,重复3次,测得平均值为VmL。
标准液滴定至终点,重复3次,测得平均值为VmL。
已知:![]() ,
,![]() 。测定时,判断达到滴定终点的现象为 ______ ,由测定数据可求得该样品中含
。测定时,判断达到滴定终点的现象为 ______ ,由测定数据可求得该样品中含![]() 的质量分数为 ______
的质量分数为 ______ ![]() 用含m、c、V的代数式表示,
用含m、c、V的代数式表示,![]()
![]() 。
。
![]() 在滴定操作正确无误的情况下,用此种测定方法测得的结果往往偏高,其原因是受空气的影响,请用离子方程式表示产生这一影响的原因 ______。
在滴定操作正确无误的情况下,用此种测定方法测得的结果往往偏高,其原因是受空气的影响,请用离子方程式表示产生这一影响的原因 ______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与社会生活密切相关,下列说法正确的是( )
A.军舰船底镶嵌锌块作正极,以防船体被腐蚀
B.汽车尾气中NO和CO可以缓慢反应生成N2和CO2,减小压强,反应速率减慢
C.金属冶炼过程是金属离子得电子变成金属单质的氧化过程
D.PM2.5颗粒![]() 微粒直径约为2.5×106m)分散在空气中形成气溶胶
微粒直径约为2.5×106m)分散在空气中形成气溶胶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A. 3.2g铜溶于过量的浓硝酸完全反应生成的气体的物质的量一定为0.1mol
B. 78gNa2S和Na2O2的混合物中阳离子与阴离子的个数比不能确定
C. 25℃HCN的电离平衡常数为5.0×10-10,则浓度均为0.10mol·L-1NaCN和HCN的混合溶液中有c(Na+)>c(CN-)>c(OH-) >c(H+)
D. Fe(NO3)2溶液中加入过量的HI溶液:Fe2++NO3-+4H++2I-=I2+Fe3++NO↑+2H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com