
【题目】 大气污染问题日益引起全民关注.
(1)PM2.5是指大气中直径小于或等于2.5μm(1μm=103nm)的颗粒物.下列说法不正确的是______(填字母序号)。
a.PM2.5主要来源于火力发电、工业生产、汽车尾气排放等过程
b.PM2.5颗粒小,所以对人体无害
c.直径介于1~2.5μm的颗粒物分散到空气中可形成胶体
d.推广使用电动汽车,可以减少PM2.5的污染
(2)某地科研工作者用五年时间研究出利用石灰乳除工业燃煤尾气中的硫(SO2、SO3)和氮(NO、NO2)的新工艺,既能净化尾气,又能获得应用广泛的CaSO4和Ca(NO2)2

硫酸型酸雨的形成过程是大气中的SO2溶于雨水生成某种弱酸,在空气中经催化氧化生成硫酸,该过程中反应的化学方程式为___________、__________.
CaSO4可以调节水泥的硬化时间.尾气中2molSO2被石灰乳逐渐吸收最终生成了1molCaSO4,该过程中转移的电子数目为___________。
③Ca(NO2)2可制成混凝土防冻剂、钢筋阻锈剂等。尾气中NO、NO2与石灰乳反应生成Ca(NO2)2的化学方程式_________________.
(3)人类活动产生的CO2长期积累,威胁到生态环境,其减排问题受到全世界关注。
工业上常用高浓度的K2CO3溶液吸收CO2,得溶液X,再利用电解法使K2CO3溶液再生,其装置示意图如下:

在阳极区发生的反应包括___________和H++HCO3-=H2O+CO2↑。
简述CO32-在阴极区再生的原理___________。
③再生装置中产生的CO2和H2在一定条件下反应生成甲醇,工业上利用该反应合成甲醇。
已知:25℃,101KPa下:
H2(g)+![]() O2(g)═H2O(g)△H1=-242kJ/mol
O2(g)═H2O(g)△H1=-242kJ/mol
CH3OH(g)+![]() O2(g)═CO2(g)+2H2O(g)△H2=-676kJ/mol
O2(g)═CO2(g)+2H2O(g)△H2=-676kJ/mol
写出CO2和H2生成气态甲醇等产物的热化学方程式____________.
【答案】(1)bc (2分);(2)① SO2+ H2O![]() H2SO3; 2H2SO3+ O2=2H2SO4 (每个方程式1分);② 2NA(2分) ③ NO + NO2+ Ca(OH)2= Ca(NO2)2+ H2O (2分)
H2SO3; 2H2SO3+ O2=2H2SO4 (每个方程式1分);② 2NA(2分) ③ NO + NO2+ Ca(OH)2= Ca(NO2)2+ H2O (2分)
(3)①4OH— —4e-= 2H2O + O2↑ ②答案1:HCO3–存在电离平衡:HCO3–![]() H++CO32-,阴极H+放电浓度减小平衡右移CO32-再生;答案2:阴极H+放电OH-浓度增大,OH-与HCO3–反应生成CO32-,CO32-再生 (3分) ③CO2(g) + 3H2(g) = CH3OH(g) + H2O(g) △H =" -50" kJ/mol
H++CO32-,阴极H+放电浓度减小平衡右移CO32-再生;答案2:阴极H+放电OH-浓度增大,OH-与HCO3–反应生成CO32-,CO32-再生 (3分) ③CO2(g) + 3H2(g) = CH3OH(g) + H2O(g) △H =" -50" kJ/mol
【解析】试题分析:(1)a.PM2.5是指大气中直径小于或等于2.5μm的颗粒物.它的主要来源是日常发电、工业生产、汽车尾气排放等过程中经过燃烧而排放的残留物,a正确;b.PM2.5表面积大,具有吸附性,能吸附大量有毒物质,b错误;c.胶体微粒直径在10-7m~10-9m之间,PM2.5粒子的大小不符合,c错误;d.减少机动车尾气排放,减少了烟尘,能降低空气中PM2.5,d正确;答案选bc;
(2)①硫酸型酸雨形成过程是SO2溶于水生成亚硫酸,SO2+H2O![]() H2SO3;亚硫酸再被空气中的氧气氧化成硫酸,2H2SO3+O2═2H2SO4;
H2SO3;亚硫酸再被空气中的氧气氧化成硫酸,2H2SO3+O2═2H2SO4;
②尾气中SO2与氧气和石灰乳反应生成CaSO4和水,反应方程式为:2SO2+O2+2Ca(OH)2═2CaSO4+2H2O,方程式中转移4mol电子,生成1mol CaSO4转移2mol电子,个数为2NA;
③尾气中NO、NO2与石灰乳反应生成Ca(NO2)2和水,反应方程式为:NO+NO2+Ca(OH)2═Ca(NO2)2+H2O;
(3)①阳极上氢氧根离子放电生成氧气和水,电极反应式为4OH--4e-═2H2O+O2↑;
②HCO3-存在电离平衡:HCO3-![]() H++CO32-,阴极H+放电浓度减小平衡右移,CO32-再生;阴极H+放电OH-浓度增大,OH-与HCO3-反应生成CO32-,CO32-再生;
H++CO32-,阴极H+放电浓度减小平衡右移,CO32-再生;阴极H+放电OH-浓度增大,OH-与HCO3-反应生成CO32-,CO32-再生;
③已知:H2(g)+1/2O2(g)═H2O(g)△H1=-242kJ/mol①
CH3OH(g)+3/2O2(g)═CO2(g)+2H2O(g)△H2=-676kJ/mol②
根据盖斯定律可知将方程式3×①-②得CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H=3×(-242kJ/mol)-(-676kJ/mol)="-50" kJ/mol。


 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:
【题目】能正确表示下列反应的离子方程式的是( )
A.Ca(HCO3)2溶液与过量NaOH溶液反应:HCO![]() +Ca2++OH-===CaCO3↓+H2O
+Ca2++OH-===CaCO3↓+H2O
B.等物质的量的MgCl2、Ba(OH)2和HCl溶液混合:Mg2++2OH-===Mg(OH)2↓
C.铜溶于稀硝酸中:Cu+4H++2NO![]() ===Cu2++2NO2↑+2H2O
===Cu2++2NO2↑+2H2O
D.FeBr2溶液中通入少量的Cl2:2Fe2++Cl2===2Fe3++2Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若某原子的外围电子排布式为4d15s2,则下列说法正确的是( )
A.该元素在元素周期表中的位置为第5周期ⅢB族
B.该元素位于d区
C.该元素为非金属元素
D.该元素原子N电子层共有8个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】香豆素﹣4是一种激光染料,应用于可调谐染料激光器。香豆素﹣4由C、H、O三种元素组成,分子球棍模型如图所示,下列有关叙述正确的是
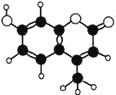
①分子式为C10H9O3
②能与Br2水发生取代反应
③能与Br2水发生加成反应
④能使酸性KMnO4溶液褪色
⑤1mol香豆素﹣4最多能与2molNaOH反应
A. ①②③ B. ③④⑤ C. ②③④ D. ②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学家合成了一种分子式为C200H200的含多个碳碳叁键的链烃,其分子中含碳碳叁键数目最多可以是( )
A. 49 B. 50 C. 51 D. 无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电化学原理在防止金属腐蚀、能量转换、物质合成等方面应用广泛。

(1)图1中,为了减缓海水对钢闸门A的腐蚀,材料B可以选择__________(填字母序号)
a.碳棒 b.锌板 c.铜板
用电化学原理解释材料B需定期拆换的原因_______________。


(2)镁燃料电池在可移动电子设备电源和备用电源等方面应用前景广阔。图2为“镁—次氯酸盐”燃料电池原理示意图,电极为镁合金和铂合金。
①E为该燃料电池的_____________极(填“正”或“负”)。F电极上的电极反应式为_____________。
②镁燃料电池负极容易发生自腐蚀产生氢气,使负极利用率降低,用化学用语解释其原因____________。
(3)乙醛酸(HOOC-CHO)是有机合成的重要中间体。工业上用“双极室成对电解法”生产乙醛酸,原理如图3所示,该装置中阴、阳两极为惰性电极,两级室均可产生乙醛酸,其中乙二醛与M电极的产物反应生成乙醛酸。
①N电极上的电极反应式为______________。
②若有2molH+通过质子交换膜,并完全参与了反应,则该装置中生成的乙醛酸为________________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了测定草酸晶体(H2C2O4·xH2O)中的 x 值,进行如下实验
(1)称取 Wg 草酸晶体,配成 100.00mL 溶液
(2)取 25.00mL 所配溶液于锥形瓶内,加入适量稀 H2SO4 后,用浓度为 amol/L 的 KMnO4 溶液滴定至 KMnO4不再褪色为止,所发生的反应为: 2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2 ↑+2MnSO4+8H2O。 试回答:
①实验中,需要的仪器有(填序号)_____,还缺少的仪器有____________(填名称)
A、托盘天平(带砝码、镊子) B、滴定管 C、100mL 的量筒 D、100mL 的容量瓶
E、烧杯 F、漏斗 G、锥形瓶 H、玻璃棒 I、药匙 J、烧瓶
②实验中,标准 KMnO4 溶液应装在_____式滴定管中,因为__________________
③若在接近滴定终点时,用少量蒸馏水将锥形瓶内壁冲洗一下,再继续滴至终点,则所测得的 x 的值会_____(填偏大、偏小、无影响)。
④在滴定过程中若用去 amol/L 的 KMnO4 溶液 VmL,则所配制的草酸溶液的物质的量浓度为____________mol/L,由此,x=_____。
⑤若滴定终点读数时俯视刻度,则计算的 x 值会_____(填偏大、偏小、无影响)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2015年诺贝尔生理学或医学奖得主屠呦呦教授在抗疟药物的研发中,发现了一种药效高于青蒿素的衍生物蒿甲醚,其分子式为:C16H2605。下列物质与蒿甲醚组成元素完全相同的是
A. 磷脂 B. 甲状腺激素 C. 叶绿素 D. 脱氧核糖
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若m g密度为ρ g·cm-3的Al2(SO4)3溶液中含SO42— n g,则该Al2(SO4)3溶液的物质的量浓度是( )
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. 
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com