
【题目】化学家合成了一种分子式为C200H200的含多个碳碳叁键的链烃,其分子中含碳碳叁键数目最多可以是( )
A. 49 B. 50 C. 51 D. 无法确定
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】有机化合物反应如下图,据此回答下列问题:

(1)乙烯的结构式为: 。
(2)写出反应②④的化学方程式:
② ,反应类型: (1分);
④ ,反应类型: (1分)。
(3)实验室常用下列装置制取乙酸乙酯,请回答相关问题:
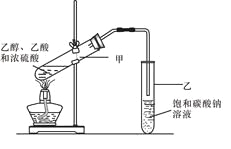
①饱和碳酸钠溶液的主要作用是 。
②若要把制得的乙酸乙酯分离出来,应采用的操作是 。
③进行该实验时,最好向试管甲中加入几块碎瓷片,其目的是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】右图是一种检验某气体化学性质的实验装置,图中B为开关。如先打开B,在A处通入干燥氯气,C中干燥红色布条颜色无变化;当关闭B时,C处干燥红色布条颜色褪去。则D瓶中盛有的不可能是
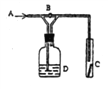
A. 饱和NaCl溶液 B. 浓H2SO4
C. 浓Na2SO4溶液 D. H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设![]() 为阿伏加德罗常数,下列说法错误的是
为阿伏加德罗常数,下列说法错误的是
A. 1 molH2所含氢气分子数为7![]()
B. 1 molAl与足量的稀盐酸溶液反应生成氢气1.5 mol
C. 在标准状况下,0.5![]() 个Cl2所占的体积约是11.2L
个Cl2所占的体积约是11.2L
D. 在标准状况下,22.4LH2O含有的分子数为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 大气污染问题日益引起全民关注.
(1)PM2.5是指大气中直径小于或等于2.5μm(1μm=103nm)的颗粒物.下列说法不正确的是______(填字母序号)。
a.PM2.5主要来源于火力发电、工业生产、汽车尾气排放等过程
b.PM2.5颗粒小,所以对人体无害
c.直径介于1~2.5μm的颗粒物分散到空气中可形成胶体
d.推广使用电动汽车,可以减少PM2.5的污染
(2)某地科研工作者用五年时间研究出利用石灰乳除工业燃煤尾气中的硫(SO2、SO3)和氮(NO、NO2)的新工艺,既能净化尾气,又能获得应用广泛的CaSO4和Ca(NO2)2

硫酸型酸雨的形成过程是大气中的SO2溶于雨水生成某种弱酸,在空气中经催化氧化生成硫酸,该过程中反应的化学方程式为___________、__________.
CaSO4可以调节水泥的硬化时间.尾气中2molSO2被石灰乳逐渐吸收最终生成了1molCaSO4,该过程中转移的电子数目为___________。
③Ca(NO2)2可制成混凝土防冻剂、钢筋阻锈剂等。尾气中NO、NO2与石灰乳反应生成Ca(NO2)2的化学方程式_________________.
(3)人类活动产生的CO2长期积累,威胁到生态环境,其减排问题受到全世界关注。
工业上常用高浓度的K2CO3溶液吸收CO2,得溶液X,再利用电解法使K2CO3溶液再生,其装置示意图如下:

在阳极区发生的反应包括___________和H++HCO3-=H2O+CO2↑。
简述CO32-在阴极区再生的原理___________。
③再生装置中产生的CO2和H2在一定条件下反应生成甲醇,工业上利用该反应合成甲醇。
已知:25℃,101KPa下:
H2(g)+![]() O2(g)═H2O(g)△H1=-242kJ/mol
O2(g)═H2O(g)△H1=-242kJ/mol
CH3OH(g)+![]() O2(g)═CO2(g)+2H2O(g)△H2=-676kJ/mol
O2(g)═CO2(g)+2H2O(g)△H2=-676kJ/mol
写出CO2和H2生成气态甲醇等产物的热化学方程式____________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在一定条件下N2与H2反应生成NH3,请回答:
①若反应物的总能量为E1,生成物的总能量为E2,且E1>E2,则该反应为________(填“吸热”或“放热”)反应。
②已知拆开1 mol H—H键、1 mol N—H键、1 mol N≡N键分别需要的能量是436 kJ、391 kJ、946 kJ,则N2与H2反应生成NH3的热化学方程式为________________。
(2) N2H4和H2O2混合可作火箭推进剂,已知:16 g液态N2H4和足量氧气反应生成N2(g)和H2O(l),放出310.6 kJ的热量;2H2O2(l)===O2(g)+2H2O(l) ΔH=-196.4 kJ·mol-1。反应N2H4(g)+O2(g)===N2(g)+2H2O(l)的ΔH=____________kJ·mol-1。N2H4和H2O2反应生成N2(g)和H2O(l)的热化学方程式为_______________________________________。
(3)实验室用50 mL 0.50 mol·L-1盐酸与50 mL某浓度的NaOH溶液在如图所示装置中反应,通过测定反应过程中所放出的热量可计算中和热。该装置有两处明显的错误,其中一处是缺少一种玻璃仪器,该仪器的名称为____________;实验室提供了0.50 mol·L-1和0.55 mol·L-1两种浓度的NaOH溶液,应选择_____________mol·L-1的NaOH溶液进行实验。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下,将224LHCl气体溶于635mL水(ρ=1.00 g/mL)中,所得盐酸溶液密度为1.18 g/mL。
(1)则此溶液物质的量浓度应为___________;
(2)若取出这种盐酸溶液10.0mL,向其中加水配制成1L溶液,则所得稀盐酸的物质的量浓度为__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com