
【题目】短周期元素X、Y、Z、W 在元素周期表中的相对位置如图所示,其中W原子的质子数是其最外层电子数的三倍。下列说法不正确的是
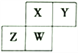
A. 原子半径:Z>W>X>Y
B. 最简单气态氢化物的热稳定性:X>Y>W>Z
C. 最高价氧化物对应水化物的酸性;X>W>Z
D. Y 与X、Y 与Z形成的化合物的化学键类型相同
【答案】B
【解析】W原子的质子数是其最外层电子数的三倍,则W为磷元素,故X、Y、Z分别为氮、氧、硅元素。A、同一周期的元素,原子序数越大,原子半径越小,不同周期的元素,原子核外电子层数越多,原子半径就越大,所以原子半径大小关系是:Z>W>X>Y,选项A正确;B、元素的非金属性越强,其相应的氢化物的稳定性就越强,元素的非金属性:Y>X>W>Z,所以元素的氢化物的稳定性:Y>X>W>Z,选项B不正确;C、元素的非金属性越强,其最高价氧化物对应的水化物的酸性越强,元素的非金属性:X>W>Z,所以它们的最高价氧化物对应水化物的酸性:X>W>Z,选项C正确;D、Y 与X、Y 与Z形成的化合物氮氧化物和二氧化硅的化学键均为共价键,类型相同,选项D正确;答案选B。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】反应4A(s)+3B(g)2C(g)+D(g),经2min B的浓度减少0.6molL﹣1 . 对此反应速率的正确表示是( )
A.用A表示的反应速率是0.8 molL﹣1s﹣1
B.分别用B,C,D表示反应的速率,其比值是3:2:1
C.在2 min末时的反应速率,用反应物B来表示是0.3 molL﹣1min﹣1
D.在这2 min内用B和C表示的反应速率的值都是相同的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】串联电路中四个电解池分别装有0.5molL﹣1的下列溶液,用惰性电极电解,连接直流电源一段时间后,溶液pH最大的是( )
A.KNO3溶液
B.NaCl溶液
C.AgNO3溶液
D.CuCl2溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 催化剂能够降低化学反应的反应热
B. 己知C(s)+O2(g)=CO2(g) △H1;C(s)+ 1/2O2(g)=CO(g) △H2。则△H1>△H2
C. 已知中和热为ΔH=-57.3 kJ·mol-1,则H2SO4(aq)与Ba(OH)2(aq)反应生成2moIH2O(l) ΔH=-114.6 kJ·mol-1
D. 甲烷的燃烧热为ΔH=-890.3 kJ·mol-1,1g 水蒸气转化为液态水放热2.4444kJ, 则lgCH4完全燃烧生成气态水放出的热量为50.14kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】胶状液氢(主要成分是H2和CH4)有望用于未来的运载火箭和空间运输系统.实验测得101kPa时,1mol H2(g)完全燃烧生成液态水,放出285.8kJ的热量;1mol CH4(g)完全燃烧生成液态水和CO2气体,放出890.3kJ的热量.下列热化学方程式书写正确的是( )
A.2H2(g)+O2(g)═2H2O(l)△H=﹣285.8 kJ/mol
B.CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=﹣890.3 kJ/mol
C.CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=﹣890.3 kJ/mol
D.CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=+890.3 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝酸是一种重要的化工原料,工业上生产硝酸的主要过程中:
(1)反应N2(g)+3H2(g)2NH3(g)△H<0;恒温时,将N2和H2的混合气体充入2L密闭容器中,10分钟后反应达到平衡,图1图象能正确表示该过程中相关量的变化的是 . (选填字母). 
(2)一定温度下,在密闭容器中充入1molN2和3molH2发生反应.若容器容积恒定,达到平衡状态时,气体的总物质的量是原来的 ![]() ,则N2的转化率a1=;若向该容器中再加入1molN2和3molH2 , 达到平衡状态时,N2的转化率为a2 , 则a2a1(填“>”、“<”或“=”).
,则N2的转化率a1=;若向该容器中再加入1molN2和3molH2 , 达到平衡状态时,N2的转化率为a2 , 则a2a1(填“>”、“<”或“=”).
(3)2NO(g)+O2(g)2NO2(g).在其他条件相同时,分别测得NO的平衡转化率在不同压强(P1、P2)下温度变化的曲线(如图2). ①比较P1、P2的大小关系:P1P2(填“>”、“<”或“=”).
②随温度升高,该反应平衡常数变化的趋势是 .
(4)硝酸厂常用如下2种方法处理尾气. ①催化还原法:催化剂存在时用H2将NO2还原为N2 .
已知:2H2(g)+O2(g)═2H2O(g)△H=﹣483.6kJ/mol
N2(g)+2O2(g)═2NO2(g)△H=+67.7kJ/mol
则H2还原NO2生成水蒸气反应的热化学方程式是 .
②碱液吸收法:用Na2CO3溶液吸收NO2生成CO2 . 若每4.6gNO2和Na2CO3溶液反应时转移电子数为0.05mol,则反应的离子方程式是 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com