
【题目】常温下,将pH和体积均相同的HNO2和CH3COOH溶液分别稀释,其pH随加水体积的变化如图所示。下列叙述正确的是
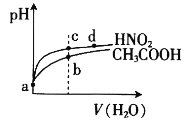
A.电离平衡常数:Ka(CH3COOH)>Ka(HNO2)
B.从c点到d点,溶液中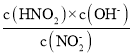 的值保持不变
的值保持不变
C.溶液中水的电离程度:b>c
D.a点时,相同体积的两溶液分别与NaOH恰好中和后,溶液中的n(Na+)相等
【答案】B
【解析】
A. 酸的酸性越强,电离平衡常数越大;
B. 电离平衡常数之与温度有关;
C. 酸能抑制水的电离,H+浓度越大,抑制程度就越大;
D. a点时同体积的两种酸,H+浓度相同,但n(HNO2)<n(CH3COOH),据此分析作答。
A. 根据图像可知酸性HNO2>CH3COOH,酸的酸性越强,电离平衡常数越大,因此Ka(HNO2) > Ka(CH3COOH),A项错误;
B. 电离平衡常数之与温度有关,温度不变电离平衡常数不变,c、d两点所处的温度相同,因此溶液中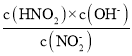 的值保持不变,B项正确;
的值保持不变,B项正确;
C. 酸性HNO2>CH3COOH,HNO2电离出的H+浓度大于CH3COOH电离出的H+浓度,H+浓度越大,抑制程度就越大,因此水的电离程度:c>b,C项错误;
D. a点时同体积的两种酸,H+浓度相同,但n(HNO2)<n(CH3COOH),因此CH3COOH反应时消耗的NaOH更多,溶液中的n(Na+)不相等,D项错误;
答案选B。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】(1)下列物质:①Cu ②NaCl晶体 ③NaHSO4 ④CO2 ⑤稀H2SO4 ⑥C2H5OH属于电解质的是(填序号,下同)_____,属于非电解质的是_____。
(2)写出下列物质在水溶液中的电离方程式:
①NaHSO4 _______;
②Al2(SO4)3 _______;
(3)按要求写出下列方程式:
①写出硫酸铜溶液中滴加氢氧化钠溶液的反应的离子方程式:_____________。
②写出能用离子方程式CO![]() +2H+=CO2↑+H2O表示的一个化学方程式:__________。
+2H+=CO2↑+H2O表示的一个化学方程式:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物X的结构![]()
![]() 其中Ⅰ、Ⅱ为未知部分的结构
其中Ⅰ、Ⅱ为未知部分的结构![]() 下列是X发生反应的转化关系图及E的信息.
下列是X发生反应的转化关系图及E的信息.
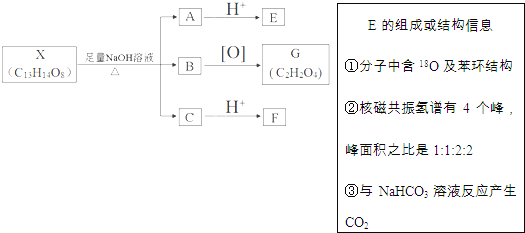
回答下列问题:
![]() 中官能团的名称为 ______ ,F不能发生和化学反应类型有 ______
中官能团的名称为 ______ ,F不能发生和化学反应类型有 ______
A.取代反应 ![]() 加成反应
加成反应 ![]() 氧化反应
氧化反应 ![]() 消去反应
消去反应
![]() 的分子式为 ______ B与G反应可生成高分子化合物M,其化学方程式是 ______
的分子式为 ______ B与G反应可生成高分子化合物M,其化学方程式是 ______
![]() 在足量NaOH溶液中反应的化学方程式为 ______
在足量NaOH溶液中反应的化学方程式为 ______
![]() 化合物E有多种同分异构体,满足下列条件的所有同分异构体有 ______ 种,任写其中一种的结构简式为 ______
化合物E有多种同分异构体,满足下列条件的所有同分异构体有 ______ 种,任写其中一种的结构简式为 ______
![]() 遇氯化铁溶液显紫色;
遇氯化铁溶液显紫色;![]() 分子中除苯环外物其中它环;
分子中除苯环外物其中它环;![]() 能发生眼镜反应.
能发生眼镜反应.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】等物质的量的N2、O2、CO2混合气体通过一定量Na2O2后,体积变为原体积的8/9(同温同压),这时混合气体中N2、O2、CO2物质的量之比为( )
A. 6: 7: 3 B. 3: 3: 2
C. 3: 4: 1 D. 6: 9: 0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下图回答下列问题。
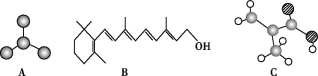
(1)图A是由4个碳原子结合成的某种烷烃(氢原子没有画出)。
①写出该有机物的系统命名法的名称:______。
②该有机物的同分异构体的核磁共振氢谱中应有___种峰。
(2)图B的键线式表示维生素A的分子结构。
①该分子的化学式为____。
②1 mol维生素A最多可与____mol H2发生加成反应。
(3)某物质只含C、H、O三种元素,其分子模型如图C所示,分子中共有12个原子(图中球与球之间的连线代表单键、双键等化学键)。
①该物质的结构简式为_________。 ②该物质中所含官能团的名称为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用酸性甲醛燃料电池为电源进行电解的实验装置如图所示,下列说法中正确的是
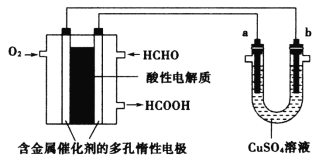
A.燃料电池工作时,负极反应为HCHO+H2O-4e-=CO2+4H+
B.当燃料电池消耗2.24L甲醛气体时,电路中理论上转移0.2mole-
C.当a、b都是铜电极时,电解的总反应方程式为:2CuSO4+2H2O![]() 2H2SO4+2Cu+O2↑
2H2SO4+2Cu+O2↑
D.电解后,消耗的甲醛和a电极上析出物质的物质的量相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列分子或离子:①CS2, ②PCl3, ③H2S, ④CH2O, ⑤H3O+, ⑥NH![]() ,⑦BF3,⑧SO2。
,⑦BF3,⑧SO2。
(1)粒子的立体构型为直线形的有____________ (填序号,下同);
(2)粒子的立体构型为V形的有______________;
(3)粒子的立体构型为平面三角形的有______________;
(4)粒子的立体构型为三角锥形的有______________;
(5)粒子的立体构型为正四面体形的有______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值。下列说法正确的是( )
A.![]() 标准状况
标准状况![]() 和
和![]() 的混合气体中含电子总数为
的混合气体中含电子总数为![]()
B.![]() 氢化钾
氢化钾![]() 与足量水反应转移电子数为
与足量水反应转移电子数为![]()
C.92g甘油![]() 丙三醇
丙三醇![]() 中含C一H键总数为
中含C一H键总数为![]()
D.![]() 溶液中
溶液中![]() 和
和![]() 数之和为
数之和为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知2HI(g)H2(g) +I2(g), 443℃时IL密闭容器中充入1 mol HI,体系中c(HI)与反应时间t的关系如图所示。下列说法正确的是
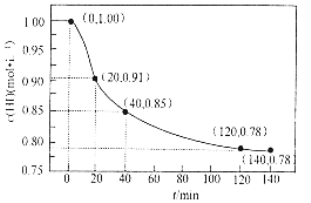
A.0~20 min内,v(H2) = 0.0045mol·L-1·min-1B.升高温度,HI会完全分解
C.40 min时,c(H2) = 0.075mol·L-1D.120 min反应达到最大限度,此时HI的转化率为78%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com