
【题目】已知常温下Ksp(AgCl)=1.8×10-10,Ksp(AgBr)=5×10-13,下列有关说法错误的是( )
A. 在饱和AgCl、AgBr的混合溶液中:![]() =360
=360
B. 向AgCl悬浊液中滴加浓NaBr溶液会产生淡黄色沉淀
C. AgCl在水中溶解度及Ksp均比在NaCl溶液中的大
D. 欲用1 L NaCl溶液将0.01 mol AgBr转化为AgCl,则c(NaCl)≥3.61 mol·L-1
【答案】C
【解析】A.已知常温下Ksp(AgCl)=1.8×10-10,Ksp(AgBr)=5×10-13,在饱和AgCl,AgBr的混合溶液中:![]() =
=![]() =360,故A正确;B.已知Ksp(AgCl)>Ksp(AgBr),溶度积大的沉淀容易转化为溶度积小的沉淀,所以向AgCl悬浊液中滴加NaBr溶液会产生淡黄色AgBr沉淀,故B正确;C.溶解度与Ksp均只与温度有关,AgCl在水中溶解度及Ksp均与在NaCl溶液中的相同,故C错误;D.用1L NaCl溶液将0.01 mol AgBr转化为AgCl,则溶液中Br-浓度变为0.01mol/L,则c(Ag+)=
=360,故A正确;B.已知Ksp(AgCl)>Ksp(AgBr),溶度积大的沉淀容易转化为溶度积小的沉淀,所以向AgCl悬浊液中滴加NaBr溶液会产生淡黄色AgBr沉淀,故B正确;C.溶解度与Ksp均只与温度有关,AgCl在水中溶解度及Ksp均与在NaCl溶液中的相同,故C错误;D.用1L NaCl溶液将0.01 mol AgBr转化为AgCl,则溶液中Br-浓度变为0.01mol/L,则c(Ag+)=![]() =
=![]() =5×10-11mol/L,则c(Cl-)=
=5×10-11mol/L,则c(Cl-)=![]() =3.6 mol/L,所以c(NaCl)≥3.61 mol/L,故D正确;故选C。
=3.6 mol/L,所以c(NaCl)≥3.61 mol/L,故D正确;故选C。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】多晶硅是单质硅的一种形态,是制造硅抛光片、太阳能电池及高纯硅制晶的主要原料。已知多晶硅第三代工业制取流程如图所示:
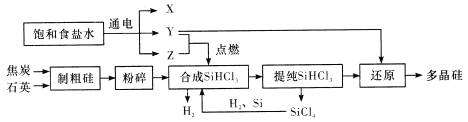
下列说法错误的是
A. Y、Z分别为H2、Cl2
B. 制取粗硅的过程中焦炭与石英会发生副反应生成碳化硅,在该副反应中,氧化剂与还原剂的物质的量之比为1:1
C. SiHCl3极易水解,其完全水解的产物为H2SiO3、H2、HCl,据此推测SiHCl3中硅元素的化合价为+2价
D. Y与SiHCl3制备多晶硅的反应属于置换反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NiSO4·6H2O是一种绿色易溶于水的晶体,可由电镀废渣(除镍外,还含有铜、锌、铁等元素)为原料获得。操作步骤如下:
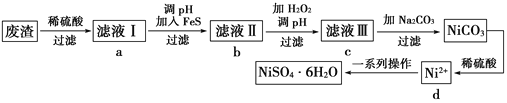
(1)向滤液Ⅰ中加入FeS是为了生成难溶于酸的硫化物沉淀而除去Cu2+、Zn2+等杂质,则除去Cu2+的离子方程式为___________________________________。
(2)对滤液Ⅱ的操作,请回答:
①往滤液Ⅱ中加入H2O2的离子方程式为________________________________。
②调滤液ⅡpH的目的是除去Fe3+,其原理是Fe3++3H2O![]() Fe(OH)3+3H+,已知25 ℃时Ksp[Fe(OH)3]=2.8×10-39,则该温度下上述反应的平衡常数K=________________。
Fe(OH)3+3H+,已知25 ℃时Ksp[Fe(OH)3]=2.8×10-39,则该温度下上述反应的平衡常数K=________________。
③检验Fe3+是否除尽的操作和现象是__________________________________________。
(3)滤液Ⅲ中溶质的主要成分是NiSO4,加Na2CO3过滤后得到NiCO3固体,再加适量稀硫酸溶解又生成NiSO4,这两步操作的目的是___________________。
(4)得到的NiSO4溶液经蒸发浓缩、冷却结晶、过滤等一系列操作可得到NiSO4·6H2O,请回答:
①在进行蒸发浓缩操作时,加热到___________________________(描述实验现象)时,则停止加热。
②为了提高产率,过滤后得到的母液要循环使用,则应该回流到流程中的________位置(选填a、b、c、d)。
③如果得到产品的纯度不够,则应该进行________(填操作名称)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量的铜粉投入FeCl3溶液中,两者恰好完全反应,完成下列问题.
(1)写出该反应的离子方程式_______________________________
(2)该反应中的氧化剂是_______,氧化产物和还原产物的物质的量之比为________
(3)若反应过程中转移了0.2mol电子,则溶解消耗的铜的质量为 ________
(4)如何检验反应后的溶液中是否含有Fe3+________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下右图所示的装置中,烧瓶中充满干燥气体a,将滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯中的液体b呈喷泉状喷出,最终几乎充满烧瓶。则a和b不满足题目要求的是
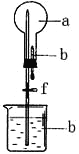
选项 | a(干燥气体) | b(液体) |
A | Cl2 | 饱和NaOH溶液 |
B | SO2 | 4mol/LNaOH溶液 |
C | NO2 | 水 |
D | NH3 | 1mol/L盐酸 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列装置所示的实验中,不能达到实验目的是
|
|
|
|
A.长时间看到Fe(OH)2白色沉淀 | B.证明ρ(煤油)< ρ(钠) < ρ(水) | C.探究氧化性: KMnO4>Cl2>I2 | D.比较NaHCO3、Na2CO3的热稳定性 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水是宝贵的自然资源。利用海水可以得到一系列产品,也可以进行废气处理。
(1)利用氯碱工业产品来处理含SO2的烟气的流程如图所示:
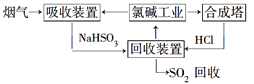
①“吸收装置”中发生反应的离子方程式是__________________________。
②上述流程中循环利用的物质是________。
(2)利用海水脱硫可以有效地解决煤燃烧过程中排放的SO2造成的一系列环境问题。其工艺流程如图所示:天然海水吸收含硫的烟气后,需要用氧气进行氧化处理,其反应的化学方程式是_____________________;氧化后的海水需要加入氢氧化钠,与之混合后才能排放。该操作的主要目的是____________________。
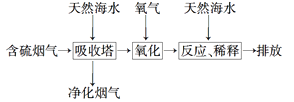
(3)从海水中提纯粗盐后的母液中含有K+、Na+和Mg2+等阳离子。对母液进行一系列的加工可制得金属镁。
①从离子反应的角度思考,在母液中加入石灰乳所起的作用是___________。
②要利用MgCl2·6H2O制得无水氯化镁,应采取的措施是________________。
③电解熔融的无水氯化镁所得的镁蒸气在特定的环境中冷却后即为固体镁。下列物质中可以用作镁蒸气的冷却剂的是________(填字母)。
A.Ar B.CO2 C.空气 D.O2 E.水蒸气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在粗制CuSO4·5H2O晶体中常含有杂质Fe2+。在提纯时为了除去Fe2+,常加入合适氧化剂,使Fe2+氧化为Fe3+,下列物质可采用的是________。
A. KMnO4 B. H2O2 C. 氯水 D. HNO3
然后再加入适当物质调整至溶液pH=4,使Fe3+转化为Fe(OH)3,可以达到除去Fe3+而不损失CuSO4的目的,调整溶液pH可选用下列中的___________。
A. NaOH B. NH3·H2O C. CuO D. Cu(OH)2
(2)甲同学怀疑调整至溶液pH=4是否能达到除去Fe3+而不损失Cu2+的目的,乙同学认为可以通过计算确定,他查阅有关资料得到如下数据,常温下Fe(OH)3的溶度积Ksp=8.0×10-38,Cu(OH)2的溶度积Ksp=3.0×10-20,通常认为残留在溶液中的离子浓度小于1×10-5 mol·L-1时就认为沉淀完全,设溶液中CuSO4的浓度为3.0 mol·L-1,则Cu(OH)2开始沉淀时溶液的pH为________,Fe3+完全沉淀时溶液的pH为________,通过计算确定上述方案________(填“可行”或“不可行”)。
(3)某学习小组用“间接碘量法”测定含有CuCl2·2H2O晶体的试样(不含能与I-发生反应的氧化性杂质)的纯度,过程如下:取0.800 g试样溶于水,加入过量KI固体,充分反应,生成CuI白色沉淀。用0.100 0 mol·L-1 Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液40.00 mL。(已知:I2+2S2O![]() ===S4O
===S4O![]() +2I-)。
+2I-)。
①可选用________________作滴定指示剂,滴定终点的现象是________________________。
②CuCl2溶液与KI反应的离子方程式为_______________________________________。
③该试样中CuCl2·2H2O的质量百分数为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在四个恒容密闭容器中按左下表相应量充入气体,发生反应2N2O(g)![]() 2N2(g)+O2(g),容器Ⅰ、Ⅱ、Ⅲ中N2O的平衡转化率如下图所示:
2N2(g)+O2(g),容器Ⅰ、Ⅱ、Ⅲ中N2O的平衡转化率如下图所示:
容器 | 容积/L | 起始物质的量/mol | ||
N2O | N2 | O2 | ||
Ⅰ | V1 | 0.1 | 0 | 0 |
Ⅱ | 1.0 | 0.1 | 0 | 0 |
Ⅲ | V3 | 0.1 | 0 | 0 |
Ⅳ | 1.0 | 0.06 | 0.06 | 0.04 |
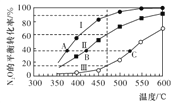
下列说法正确的是
A. 该反应的正反应放热
B. 相同温度下反应相同时间,平均反应速率:v(Ⅰ)>v(Ⅱ)
C. 容器Ⅳ在470℃进行反应时,起始反应速率:v正(N2O)<v逆(N2O)
D. 图中A、B、C三点处容器内总压强:pA(I)< pB(Ⅱ)<pC(Ⅲ)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com