
【题目】(1)在粗制CuSO4·5H2O晶体中常含有杂质Fe2+。在提纯时为了除去Fe2+,常加入合适氧化剂,使Fe2+氧化为Fe3+,下列物质可采用的是________。
A. KMnO4 B. H2O2 C. 氯水 D. HNO3
然后再加入适当物质调整至溶液pH=4,使Fe3+转化为Fe(OH)3,可以达到除去Fe3+而不损失CuSO4的目的,调整溶液pH可选用下列中的___________。
A. NaOH B. NH3·H2O C. CuO D. Cu(OH)2
(2)甲同学怀疑调整至溶液pH=4是否能达到除去Fe3+而不损失Cu2+的目的,乙同学认为可以通过计算确定,他查阅有关资料得到如下数据,常温下Fe(OH)3的溶度积Ksp=8.0×10-38,Cu(OH)2的溶度积Ksp=3.0×10-20,通常认为残留在溶液中的离子浓度小于1×10-5 mol·L-1时就认为沉淀完全,设溶液中CuSO4的浓度为3.0 mol·L-1,则Cu(OH)2开始沉淀时溶液的pH为________,Fe3+完全沉淀时溶液的pH为________,通过计算确定上述方案________(填“可行”或“不可行”)。
(3)某学习小组用“间接碘量法”测定含有CuCl2·2H2O晶体的试样(不含能与I-发生反应的氧化性杂质)的纯度,过程如下:取0.800 g试样溶于水,加入过量KI固体,充分反应,生成CuI白色沉淀。用0.100 0 mol·L-1 Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液40.00 mL。(已知:I2+2S2O![]() ===S4O
===S4O![]() +2I-)。
+2I-)。
①可选用________________作滴定指示剂,滴定终点的现象是________________________。
②CuCl2溶液与KI反应的离子方程式为_______________________________________。
③该试样中CuCl2·2H2O的质量百分数为__________。
【答案】 B CD 4 3.3 可行 淀粉溶液 溶液由蓝色变成无色且半分钟不变化 2Cu2++4I-===2CuI↓+I2 85.5%
【解析】(1)除杂质至少要满足两个条件:①加入的试剂只能与杂质反应,不能与原物质反应;②反应后不能引入新的杂质,四个选项中,只有双氧水氧化后生成水,双氧水受热见光易分解,没有多余杂质;调整溶液的pH时,加入的物质不能引进新的杂质粒子,氢氧化钠中含有钠离子,氨水反应后生成铵根离子,所以氢氧化钠和氨水能引进新的杂质离子,CuO粉末、Cu(OH)2悬浊液反应后生成铜离子和水而不引进新的杂质离子,故选CD,故答案为:B;CD;
(2)Cu(OH)2的溶度积Ksp=3.0×10-20,溶液中CuSO4的浓度为3.0molL-1,c(Cu2+)=3.0molL-1;依据溶度积常数c(Cu2+)×c2(OH-)=3.0×10-20 ;c2(OH-)=![]() =10-20;得到c(OH-)=10-10mol/L,依据水溶液中的离子积c(H+)×c(OH-)=10-14,求得c(H+)=10-4mol/L,溶液pH=4,则Cu(OH)2开始沉淀时溶液的pH为4;残留在溶液中的离子浓度小于1×10-5molL-1时就认为沉淀完全,Fe(OH)3的溶度积Ksp=8.0×10-38,c(Fe3+)×c3(OH-)=8.0×10-38;c3(OH-)=
=10-20;得到c(OH-)=10-10mol/L,依据水溶液中的离子积c(H+)×c(OH-)=10-14,求得c(H+)=10-4mol/L,溶液pH=4,则Cu(OH)2开始沉淀时溶液的pH为4;残留在溶液中的离子浓度小于1×10-5molL-1时就认为沉淀完全,Fe(OH)3的溶度积Ksp=8.0×10-38,c(Fe3+)×c3(OH-)=8.0×10-38;c3(OH-)=![]() =8.0×10-33;c(OH-)=2×10-11mol/L;水溶液中的离子积c(H+)×c(OH-)=10-14;c(H+)=5×10-4mol/L,则pH=3.3;通过计算可知pH=4能达到除去Fe3+而不损失Cu2+的目的,则方案可行,故答案为:4;3.3;可行。
=8.0×10-33;c(OH-)=2×10-11mol/L;水溶液中的离子积c(H+)×c(OH-)=10-14;c(H+)=5×10-4mol/L,则pH=3.3;通过计算可知pH=4能达到除去Fe3+而不损失Cu2+的目的,则方案可行,故答案为:4;3.3;可行。
(3)测定含有CuCl22H2O晶体的试样(不含能与I-发生反应的氧化性质杂质)的纯度,过程如下:取0.800g试样溶于水,加入过量KI固体,充分反应,生成白色沉淀.用0.1000mol/L Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液40.00mL;反应的化学方程式为:2Na2S2O3+I2═Na2S4O6+2NaI。
①硫代硫酸钠滴定碘单质,利用碘单质遇淀粉变蓝选择指示剂为淀粉;终点为蓝色褪去,溶液中30s内不恢复原色,故答案为:淀粉溶液;溶液由蓝色变成无色且半分钟不变化;
②CuCl2溶液与KI反应的离子方程式为为:2Cu2++4I-=2CuI↓+I2,故答案为:2Cu2++4I-=2CuI↓+I2;
③依据2Na2S2O3+I2═Na2S4O6+2NaI,2Cu2++4I-=2CuI↓+I2;
得到 2Na2S2O3 ~2Cu2+
2 2
0.1000mol/L×0.0400L0.004mol
则CuCl22H2O的物质的量为:0.004mol,试样中CuCl22H2O的质量百分数为:![]() ×100%=85.5%,故答案为:85.5%。
×100%=85.5%,故答案为:85.5%。


科目:高中化学 来源: 题型:
【题目】硅是无机非金属材料的主角,硅的氧化物和硅酸盐约占地壳质量的90%以上。
(1)计算机芯片和太阳能电池的主要成分是________,光导纤维的主要成分是___________。
(2)工艺师常用氢氟酸来雕刻玻璃,该反应的化学方程式为__________。
(3)工业上可利用水玻璃和盐酸反应制备硅酸凝胶后,进一步脱水处理可得到硅胶,写出水玻璃和盐酸反应的离子方程式_______。
(4)玉石的主要成分基本都属于硅酸盐,翡翠的主要成分为NaAlSi2O6,将其表示为氧化物形式为___。
(5)高纯度单晶硅可以按下列方法制备:
SiO2 ![]() Si(粗)
Si(粗) ![]() SiHCl3
SiHCl3 ![]() Si(纯)
Si(纯)
写出步骤①的化学方程式_______________________________________。
步骤②的产物经过冷凝后得到的SiHCl3(沸点33.0℃)中含有少量的SiCl4(沸点57.6℃),提纯SiHCl3主要操作的名称是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知常温下Ksp(AgCl)=1.8×10-10,Ksp(AgBr)=5×10-13,下列有关说法错误的是( )
A. 在饱和AgCl、AgBr的混合溶液中:![]() =360
=360
B. 向AgCl悬浊液中滴加浓NaBr溶液会产生淡黄色沉淀
C. AgCl在水中溶解度及Ksp均比在NaCl溶液中的大
D. 欲用1 L NaCl溶液将0.01 mol AgBr转化为AgCl,则c(NaCl)≥3.61 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是以铅蓄电池为电源,模拟氯碱工业电解饱和食盐水的装置图(C、D均为石墨电极)。
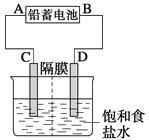
已知:铅蓄电池在放电时发生下列电极反应:
负极Pb+SO![]() -2e-===PbSO4
-2e-===PbSO4
正极PbO2+4H++SO![]() +2e-===PbSO4+2H2O
+2e-===PbSO4+2H2O
(1)请写出电解饱和食盐水的化学方程式_______________________________________。
(2)若在电解池中C极一侧滴酚酞试液,电解一段时间后未呈红色,说明铅蓄电池的A极为________极。
(3)用铅蓄电池电解1 L饱和食盐水(食盐水足量)时,
①若收集到11.2 L(标准状况下)氯气,溶液pH=_________________。
②若铅蓄电池消耗H2SO4 2 mol,则可收集到H2的体积(标准状况下)为___________L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用铝土矿(主要成分是Al2O3、Fe2O3、SiO2)提纯Al2O3做冶炼铝的原料,提取的操作过程可用以下流程图表示:
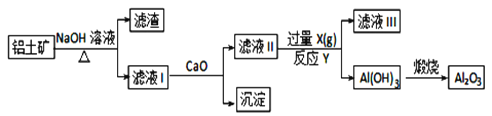
已知:Na2SiO3 + Ca(OH)2= CaSiO3↓+ 2NaOH
(1)氢氧化钠溶液浸取铝土矿时,发生反应的离子方程式有:______________________、______________________。
(2)滤液II中通入过量的气体X是________。反应的化学方程式:____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是( )
A. 0.01mol/L NH4Al(SO4)2溶液与0.02mol/L Ba(OH)2溶液等体积混合:NH4++Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+Al(OH)3↓+NH3·H2O
B. FeCl2酸性溶液放在空气中变质:2Fe2++4H++O2=2Fe3++2H2O
C. 用CH3COOH溶解CaCO3:CaCO3+2H+=Ca2++H2O+CO2↑
D. 电解MgCl2水溶液的离子方程式:2Cl-+2H2O![]() H2↑+Cl2↑+2OH-
H2↑+Cl2↑+2OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫代硫酸钠晶体(Na2S2O3·5H2O,M=248 g·mol1)可用作定影剂、还原剂。回答下列问题:
(1)已知:Ksp(BaSO4)=1.1×1010,Ksp(BaS2O3)=4.1×105。市售硫代硫酸钠中常含有硫酸根杂质,选用下列试剂设计实验方案进行检验:
试剂:稀盐酸、稀H2SO4、BaCl2溶液、Na2CO3溶液、H2O2溶液
实验步骤 | 现象 |
①取少量样品,加入除氧蒸馏水 | ②固体完全溶解得无色澄清溶液 |
③___________ | ④___________,有刺激性气体产生 |
⑤静置,___________ | ⑥___________ |
(2)利用K2Cr2O7标准溶液定量测定硫代硫酸钠的纯度。测定步骤如下:
①溶液配制:称取1.2000 g某硫代硫酸钠晶体样品,用新煮沸并冷却的蒸馏水在__________中溶解,完全溶解后,全部转移至100 mL的_________中,加蒸馏水至____________。
②滴定:取0.00950 mol·L1的K2Cr2O7标准溶液20.00 mL,硫酸酸化后加入过量KI,发生反应: Cr2O72+6I+14H+![]() 3I2+2Cr3++7H2O。然后用硫代硫酸钠样品溶液滴定至淡黄绿色,发生反应:I2+2S2O32
3I2+2Cr3++7H2O。然后用硫代硫酸钠样品溶液滴定至淡黄绿色,发生反应:I2+2S2O32![]() S4O62+2I。加入淀粉溶液作为指示剂,继续滴定,当溶液__________,即为终点。平行滴定3次,样品溶液的平均用量为24.80 mL,则样品纯度为_________%(保留1位小数)。
S4O62+2I。加入淀粉溶液作为指示剂,继续滴定,当溶液__________,即为终点。平行滴定3次,样品溶液的平均用量为24.80 mL,则样品纯度为_________%(保留1位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组探究镁与CO2、NO2的反应。
(1)实验发现点燃的镁条能在CO2气体中继续燃烧,产生黑、白两种固体,请用化学反应解释该现象_____。
(2)该小组采用类比Mg与CO2反应的思路对Mg与NO2的反应进行预测,写出Mg与NO2反应的化学方程式_____。
(3)设计实验验证猜测(用于连接玻璃管的乳胶管均内衬锡纸)。
资料信息:2NO2+2NaOH=NaNO3+NaNO2+H2O。

①装置A中的试剂是_____。
②干燥管和装置B的作用分别是_____、_____。
③实验开始时正确的操作步骤是_____。
a.通入NO2
b.打开弹簧夹
c.点燃酒精灯
d.当硬质玻璃管充满红棕色气体后,关闭弹簧夹
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式不正确的是
A. 氯气溶于水:Cl2+H2O![]() H++Cl-+HClO
H++Cl-+HClO
B. Fe和盐酸反应:Fe+2H+ ═Fe3++H2↑
C. NO2溶于水的反应:3NO2+H2O ═ 2H+ + 2NO3- + NO
D. 氧化铜与硫酸反应:CuO+2H+═ Cu2++H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com