
科目:高中化学 来源: 题型:选择题
| 弱酸 | CH3COOH | HCN | H2CO3 |
| 电离平衡常数(25℃) | K1=1.8×10-5 | K1=4.9×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
| A. | 等物质的量浓度时:pH(Na2CO3)>pH(NaCN)>pH(NaHCO3)>pH(CH3COONa) | |
| B. | 中和等体积、等pH的CH3COOH溶液和HCN溶液消耗NaOH的量前者大于后者 | |
| C. | 向NaCN中通入少量的CO2:CN -+H2O+CO2=HCO3 -+HCN | |
| D. | 0.2mol/L HCN与0.1mol/L NaOH溶液等体积混合后显碱性,则c(Na+)>c(CN-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 化学反应 | 测量依据(单位时间内) |
| A | CO(g)+H2O(g)=CO2(g)+H2(g) | 压强变化 |
| B | Zn+H2SO4=ZnSO4+H2 | H2体积 |
| C | 2NO2?N2O4 | 颜色深浅 |
| D | Ca(OH)2+Na2CO3=CaCO3↓+2NaOH | 沉淀质量 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol H3PO4的质量为98g.mol-1 | B. | H3PO4的摩尔质量为98 g | ||
| C. | 9.8 g H3PO4含有NA个H3PO4分子? | D. | NA个H3PO4分子的质量为98g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
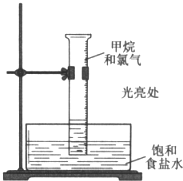 甲烷与氯气在光照条件下发生反应(装置如图),实验现象及解释均正确的是( )
甲烷与氯气在光照条件下发生反应(装置如图),实验现象及解释均正确的是( )| 现象 | 解释 | |
| A. | 量筒内气体颜色逐渐变浅 | 甲烷被氯气还原 |
| B. | 量筒内出现少量白雾 | 生成HCl气体 |
| C. | 量筒内壁产生油状液滴 | 油状液体是CCl4 |
| D. | 量筒中液面降低 | 生成液态产物 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | NaHCO3═Na++H++CO32- | B. | H2SO4═2H++SO42- | ||
| C. | FeCl3═Fe3++Cl3- | D. | Ba(OH)2═Ba2++2OH- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com