
【题目】为了除去氯化铁溶液中少量的氯化亚铁杂质,在不引入新的杂志的前提下,应选择的试剂是
A.稀硝酸B.氢氧化钠溶液C.氯水D.铁粉
科目:高中化学 来源: 题型:
【题目】有机物A的分子式为C10H803能与NaHCO3反应,在一定条件下存在如下转化关系:
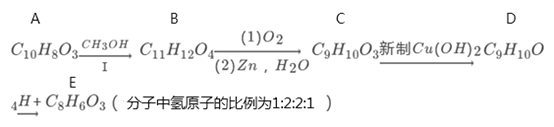
已知:
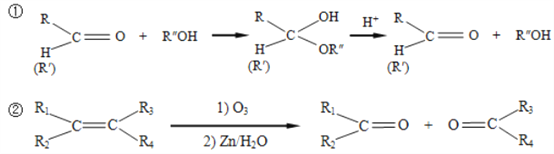
请回答下列问题:
(1)有机物A的结构简式为:___________。
(2)有机物B中含氧官能团的名称是:___________。
(3)反应I的作用为:___________。
(4)写出C→D的化学方程式:___________。
(5)F(C8H8O3)是由E与氢气在一定条件下反应得到的。F在一定条件下可以形成高分子,请写出该反应的化学方程式:_____________。
(6)E有多种同分异构体,其中满足下列条件的同分异构体共有______种(已知碳碳三键、碳碳双键与羟基相连不稳定)。
A.除苯环外无其他环且无一O—O—键
B.能与FeCl3溶液发生显色反应
C.苯环上一氯代物只有两种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:
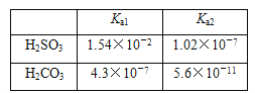
(1)在相同浓度的H2SO3和H2CO3的溶液中,用“>”“<”或“=”填空。
c(H+):H2SO3________H2CO3;c(SO![]() )________c(CO
)________c(CO![]() );c(H2SO3)________c(H2CO3);溶液导电能力:H2SO3________H2CO3。
);c(H2SO3)________c(H2CO3);溶液导电能力:H2SO3________H2CO3。
(2)HSO![]() 的电离平衡常数表达式为________________。
的电离平衡常数表达式为________________。
(3)H2SO3溶液与NaHCO3溶液反应的主要离子方程式为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】卤族元素的单质(F2、Cl2、Br2、I2)与H2反应过程中的能量变化如右图所示,其中a、b、c、d分别表示卤族中某一元素的单质,△E为相同物质的量的单质与H2反应过程中的能量变化(△E越大,表明反应越容易发生).请回答下列问题: 
(1)d为 , 从d的水溶液中提取d的方法是 .
(2)红热的铜丝与b单质反应的现象为 .
(3)a与H2反应的化学方程式为 , b与H2反应的条件为 .
(4)由该能量变化示意图可得出的结论是同一主族,自上而下,元素的非金属性依次 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32、SO42、NO3中的几种。①若加入锌粒,产生无色无味的气体;②若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示。则下列说法正确的是
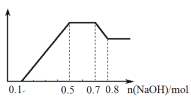
A.溶液中一定不含CO32,可能含有SO42和NO3
B.溶液中n(NH4+)=0.2mol
C.溶液中的阳离子只有H+、Mg2+、Al3+
D.n(H+)∶n(Al3+)∶n(Mg2+) = 1∶1∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气里含有NO气体是由于内燃机燃烧的高温引起氮气和氧气反应所致:N2(g)+O2(g)![]() 2NO(g) ΔH>0。已知该反应在2 404 ℃时,平衡常数K=64×10-4。请回答:
2NO(g) ΔH>0。已知该反应在2 404 ℃时,平衡常数K=64×10-4。请回答:
(1)某温度下,向2 L的密闭容器中充入N2和O2各1 mol,5分钟后O2的物质的量为0.5 mol,则N2的反应速率为___。
(2)假定该反应是在恒容条件下进行,判断该反应达到平衡的标志___(填字母序号)。
A.消耗1 mol N2同时生成1 mol O2
B.混合气体密度不变
C.混合气体平均相对分子质量不变
D.2v正(N2)=v逆(NO)
(3)将N2、O2的混合气体充入恒温恒容密闭容器中,下列变化趋势正确的是__(填字母序号)。

(4)向恒温恒容的密闭容器中充入等物质的量的N2和O2,达到平衡状态后再向其中充入一定量NO,重新达到化学平衡状态。与原平衡状态相比,此时平衡混合气体中NO的体积分数_____(填“变大”“变小”或“不变”)。
(5)该温度下,某时刻测得容器内N2、O2、NO的浓度分别为2.5×10-1 mol·L-1、4.0×10-2 mol·L-1和3.0×10-3 mol·L-1,此时反应________________(填“处于化学平衡状态”“向正反应方向进行”或“向逆反应方向进行”),理由是_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于铁及其化合物下列说法正确的是
A.铁是地壳含量最高的金属元素
B.四氧化三铁是一种红棕色难溶于水的固体
C.铁与灼热水蒸气反应生成氧化铁和氢气
D.铁在氯气蒸汽中燃烧可生成FeCl3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A+B→X+Y+H2O(未配平,反应条件略去)是中学常见反应的化学方程式,请回答:
(1)若Y为黄绿色气体:
①当A,B的物质的量之比为1:4且A为黑色固体时,该反应的离子方程式是;
②当A,B的物质的量之比为1:6时,写出该反应的化学方程式,并用双线桥表示反应过程中的电子转移: .
③实验室处理尾气Y时常用NaOH而不用NaHSO3溶液,其原因是(用离子反应方程式表示) .
(2)若A为单质,B为无色油状黏稠液体,当 A,B的物质的量之比为1:2时,则A可能为 , 检查其中刺激性气体产物X的方法是 .
(3)常温下A在B的浓溶液中会“钝化”,且A可溶于X溶液中,若A为金属单质,A和B以物质的量之比1:4反应.
①过量的A和100mL2mol/L的B溶液充分反应后将溶液稀释至500mL后溶液中阴离子的物质的量浓度为 .
②含 a mol X的溶液溶解了一定量A后,若溶液中两种金属阳离子的物质的量之比为1:2时,则被还原的X是mol.
(4)若A,B,X,Y均为化合物.向A溶液中加入硝酸酸化的AgNO3溶液,产生白色沉淀;B的焰色为黄色.则A与B按物质的量之比1:4反应后,溶液中溶质的化学式为 .
(5)若A,B,X,Y均为化合物.X为极易溶于水的气体,则盐A是盐,生成气体X的离子方程式为 , 检验该气体的方法是 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com