
| 配 料 | 氯化钠、碘酸钾 |
| 含碘量 保质期 食用方法 贮存指南 | (20mg-40mg)/kg 18个月 勿长时间炖妙 避热、避光、密闭、防潮 |


 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案科目:高中化学 来源: 题型:
| A、化学反应一步完成与分几步完成,反应热是不同数值 |
| B、盖斯定律解决的是化学反应过程问题 |
| C、盖斯定律在科研中的重要作用在于可以解决反应很慢或不直接发生的反应的反应热问题 |
| D、无法用盖斯定律计算反应热 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氟利昂是一类含氟和氯的卤代烃 |
| B、氟利昂化学性质稳定,有毒 |
| C、氟利昂大多无色、无味、无毒 |
| D、在平流层中,氟利昂在紫外线照射下,分解产生的氯原子可引发损耗臭氧层的循环反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、水、汽油、酒精 |
| B、AgNO3、NaOH、KI |
| C、NaCl、NaBr、NaI |
| D、汽油、酒精、NaCl |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、鉴别两种无色溶液Na2CO3与NaHCO3可以用石灰水 |
| B、Mg和Cu的冶炼方法一定要用相同方法:热还原法 |
| C、SO2与CO2对环境污染的原理:均形成酸雨 |
| D、Na2SiO3与Na2O?SiO2是同种物质:都是硅酸盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
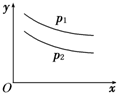 反应:L(s)+aG(g)?bR(g)达到平衡,温度和压强对该反应的影响如图所示,图中:压强P1>P2,x轴表示温度,y轴表示平衡混合气中G的体积分数;据此可判断( )
反应:L(s)+aG(g)?bR(g)达到平衡,温度和压强对该反应的影响如图所示,图中:压强P1>P2,x轴表示温度,y轴表示平衡混合气中G的体积分数;据此可判断( )| A、上述反应是放热反应 |
| B、上述反应是吸热反应 |
| C、a>b |
| D、无法确定a、b的大小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com