
【题目】每年10月23日上午6:02到晚上6:02被脊为“摩尔日"(Mole Day),这个时间的美式写法为6:0210/23,外观与阿伏加德罗常数6.02×1023相似。NA为阿伏加德罗常数的值,下列说法正确的是
A. 标准状况下22.4 LNO与11.2LO2 充分反应,产物的分子数为NA
B. 0.1mol/L的Na2SO4溶液中,SO42- 数目是0.1NA
C. 标准状况下.22.4L氯气与足量铁粉充分反应,转移的电子数为3NA
D. 0.1molCH4的核外电子数为NA
 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中化学 来源: 题型:
【题目】某温度下,体积一定的密闭容器中进行如下反应:X(g)+Y(g) ![]() Z(g)+W(s), △H>0下列叙述正确的是( )
Z(g)+W(s), △H>0下列叙述正确的是( )
A. 加入少量W,逆反应速度增大 B. 当容器中气体压强不变时,反应达到平衡
C. 升高温度,平衡逆向移动 D. 平衡后加入X,上述反应的△H增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】双氧水(H2O2)和水都是极弱的电解质,但H2O2 溶液显弱酸性。把H2O2 看成二元弱酸,则下列化学方程式不正确的是
A. H2O2 在水中电离的离子方程式:H2O2![]() H++HO2-
H++HO2-
B. 少量Na2O2与稀盐酸反应的离子方程式:O22-+2H+==H2O2
C. H2O2 稀溶液与Ba(OH)2稀溶被反应生成正盐的化学方程式:H2O2 +Ba(OH)2=BaO2+2H2O
D. H2O2 稀溶液与Ba(OH)2 稀溶液反应生成酸式盐的化学方程:2H2O2 +Ba(OH)2=Ba(HO2)2+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在反应 3 Cl2 + 6KOH = 5KCl + KClO3 + 3H2O 中,被氧化的氯原子与被还原的氯原子的质量之比是
A. 1:6 B. 6:1 C. 5:1 D. 1:5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素是构成我们生活的世界中一切物质的“原材料”.
(1)自18世纪以来,科学家们不断探索元素之谜.通过从局部到系统的研究过程,逐渐发现了元素之间的内在联系.下面列出了几位杰出科学家的研究工作.
序号 | ① | ② | ③ | ④ |
科学家 | 纽兰兹 | 道尔顿 | 德贝莱纳 | 尚古尔多 |
工作 | 发现“八音律”,指出从某一指定的元素起,第八个元素是第一个元素的某种重复 | 创立 近代原子论,率先开始相对原子质量的测定工作 | 发现了5组性质相似的“三元素组”,中间元素的相对原子质量为前后两种元素相对原子质量的算术平均值 | 认为 各元素组之间并非毫不相关,可以用相对原子质量把它们按从小到大的顺序串联 |
上述科学家的研究按照时间先后排序合理的是(填数字序号).
(2)1869年,门捷列夫在前人研究的基础上制出了第一张元素周期表,如图1所示. 
①门捷列夫将已有元素按照相对原子质量排序,同一(填“横行”或“纵列”)元素性质相似.结合表中信息,猜想第4列方框中“?=70”的问号表达的含义是 , 第5列方框中“Te=128?”的问号表达的含义是 .
②到20世纪初,门捷列夫周期表中为未知元素留下的空位逐渐被填满.而且,随着原子结构的逐渐揭秘,科学家们发现了元素性质不是随着相对原子质量递增呈现周期性变化,而是随着原子序数(核电荷数)递增呈现周期性变化.其本质原因是(填字母序号).
A.随着核电荷数递增,原子核外电子排布呈现周期性变化
B.随着核电荷数递增,原子半径呈现周期性变化
C.随着核电荷数递增,元素最高正化合价呈现周期性变化
(3)在现有的元素周期表中有A,B,D,E,X、Y、Z七种短周期元素.X与Y处于同一周期,Y的最高价氧化物的水化物与强酸、强碱均能反应.Z的单质常温下为气态,同条件下相对于氢气的密度比为35.5.其余信息如图2所示: ①上述七种元素中,处于第二周期的有(用元素符号表示,下同),X在周期表中的位置是 .
②E的原子结构示意图为 , 写出Z元素气态氢化物的电子式: .
③B单质与E的最高价氧化物的水化物在一定条件下发生反应的化学方程式为;Y单质与X的最高价氧化物的水化物溶液反应的离子方程式为 .
④B和D的最高价氧化物的水化物的化学式分别为、 , 二者酸性前者(填“强于”或“弱于”)后者,原因是B和D的非金属性有差异,利用原子结构解释产生差异的原因: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列两种物质发生反应 ①Na和O2②AlCl3与氨水 ③水玻璃与CO2④Fe与Cl2⑤Fe和稀HNO3,因反应物用量或反应条件的不同而生成不同产物的是( )
A.①②③④⑤B.①②③⑤C.①②⑤D.①③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前工业上合成氨的反应原理为:N2(g)+3H2(g) ![]() 2NH3(g) ΔH=-92.4 KJ/mol
2NH3(g) ΔH=-92.4 KJ/mol
(1)在恒温恒容条件下,向反应平衡体系中充入氮气,达到新平衡时,c(H2)将______(填“增大”、“减小”、“不变”或“无法判断”,下同),c(N2)·c(H2)将_______。
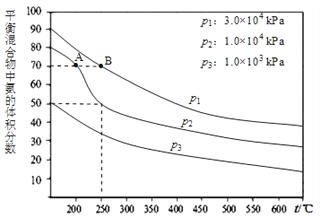
(2)下图为合成氨反应在不同温度和压强、使用相同催化剂条件下,初始时氮气、氢气的体积比为1:3时,平衡混合物中氨的体积分数。若分别用VA(NH3)和VB(NH3)表示从反应开始至达平衡状态A、B时的化学反应速率,则VA(NH3)_____VB(NH3)(填“>、“<”或“=")
(3)①若恒温恒压下,在一容积可变的容器中,达到平衡状态时,N2、H2、NH3各1mol,若此时再充入3molN2,则平衡____移动(“向正向“向逆向”“不”);
②若氮气与氢气以1:1混合反应时,达到平衡后,如果升高温度氮气的体积分数将____(“变大”“变小”不变”下同);如果增大压强氮气的体积分数将___。
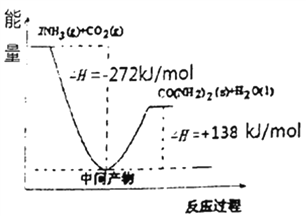
(4)H2NCOONH4是工业合成尿素的中间产物,该反应的能量变化如图所示:用CO2和氨合成尿素的热化学方程式为________。
(5)工业生产中逸出的氨可用稀硫酸吸收。若恰好生成NH4HSO4,该溶液中各离子的物质的量浓度由大到小的顺序是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.十氢萘是具有高储氢密度的氢能载体,经历“十氢萘(C10H18)→四氢萘(C10H12)→萘(C10H8)”的脱氢过程释放氢气。已知:
C10H18(l)![]() C10H12(l)+3H2(g) △H1
C10H12(l)+3H2(g) △H1
C10H12(l)![]() C10H8(l)+2H2(g) △H2
C10H8(l)+2H2(g) △H2
△H1>△H2>0;C10H18→C10H12的活化能为Ea1,C10H12→C10H8的活化能为Ea2,十氢萘的常压沸点为192℃;在192℃,液态十氢萘的脱氢反应的平衡转化率约为9%。请回答:
(1)有利于提高上述反应平衡转化率的条件是_________。
A.高温高压 B.低温低压 C.高温低压 D.低温高压
(2)研究表明,将适量的十萘奈置于恒容密闭反应器中,升高温度带来高压,该条件下也可显著释氢,理由是______________________________________________________。
(3)温度335℃,在恒容密闭反应器中进行高压液态十氢萘(1.00 mol)催化脱氢实验,测得C10H12和C10H8的产率x1和x2(以物质的量分数计)随时间变化关系,如图1所示。


①在8 h时,反应体系内氢气的量为__________mol(忽略其他副反应)。
②x1显著低于x2的原因是________________________________________。
③在图2中绘制“C10H18→C10H12→C10H8”的“能量~反应过程”示意图。
Ⅱ.科学家发现,以H2O和N2为原料,熔融NaOH-KOH为电解质,纳米Fe2O3作催化剂,在250℃和常压下可实现电化学合成氨。阴极区发生的变化可视为按两步进行,请补充完整。
(4)电极反应式:________________________________和2Fe+3H2O+N2=Fe2O3+2NH3。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com