
����Ŀ������ʮ�����Ǿ��иߴ����ܶȵ��������壬������ʮ������C10H18������������C10H12��������C10H8��������������ͷ���������֪��
C10H18(l)![]() C10H12(l)��3H2(g) ��H1
C10H12(l)��3H2(g) ��H1
C10H12(l)![]() C10H8(l)��2H2(g) ��H2
C10H8(l)��2H2(g) ��H2
��H1����H2��0��C10H18��C10H12�Ļ��ΪEa1��C10H12��C10H8�Ļ��ΪEa2��ʮ�����ij�ѹ�е�Ϊ192������192����Һ̬ʮ���������ⷴӦ��ƽ��ת����ԼΪ9������ش�
��1�����������������Ӧƽ��ת���ʵ�������_________��
A�����¸�ѹ B�����µ�ѹ C�����µ�ѹ D�����¸�ѹ
��2���о���������������ʮ�������ں����ܱշ�Ӧ���У������¶ȴ�����ѹ����������Ҳ���������⣬������______________________________________________________��
��3���¶�335�����ں����ܱշ�Ӧ���н��и�ѹҺ̬ʮ������1.00 mol��������ʵ�飬���C10H12��C10H8�IJ���x1��x2�������ʵ��������ƣ���ʱ��仯��ϵ����ͼ1��ʾ��


����8 hʱ����Ӧ��ϵ����������Ϊ__________mol��������������Ӧ����
��x1��������x2��ԭ����________________________________________��
����ͼ2�л�����C10H18��C10H12��C10H8��������������Ӧ������ʾ��ͼ��
������ѧ�ҷ��֣���H2O��N2Ϊԭ�ϣ�����NaOH��KOHΪ����ʣ�����Fe2O3����������250���ͳ�ѹ�¿�ʵ�ֵ绯ѧ�ϳɰ��������������ı仯����Ϊ���������У��벹��������
��4���缫��Ӧʽ��________________________________��2Fe��3H2O��N2��Fe2O3��2NH3��
���𰸡� C ��Ӧ���ȣ��¶����ߣ�ƽ�������ƶ������ͬʱ���¶����ߵ���ʮ����������Ũ������ƽ�������ƶ��������������������� ��1.951���ڷ�Ӧ2�Ļ�ܱȷ�Ӧ1С����ͬ�¶��·�Ӧ2���죬������ͬʱ���ڣ����ɵ��������ֶ�ת��Ϊ������x1��������x2.  Fe2O3+6e-+3H2O=2Fe+6OH
Fe2O3+6e-+3H2O=2Fe+6OH
������������(1)C10H18(l)![]() C10H12(l)��3H2(g) ��H1��C10H12(l)
C10H12(l)��3H2(g) ��H1��C10H12(l)![]() C10H8(l)��2H2(g) ��H2����H1����H2��0����Ϊ���ȷ�Ӧ���Ҷ�������������ʵ�������ķ�Ӧ��
C10H8(l)��2H2(g) ��H2����H1����H2��0����Ϊ���ȷ�Ӧ���Ҷ�������������ʵ�������ķ�Ӧ��
A�������¶ȣ�ƽ�������ƶ���ƽ��ת������������ѹǿ��ƽ�������ƶ���ƽ��ת���ʼ�С����A����B�������¶ȣ�ƽ�������ƶ���ƽ��ת���ʼ�С����B����C�������¶ȣ�ƽ�������ƶ���ƽ��ת��������Сѹǿ��ƽ�������ƶ���ƽ��ת��������C��ȷ��D�������¶ȣ�ƽ�������ƶ���ƽ��ת���ʼ�С����D����ѡC��
(2)�ܷ�ӦΪ�÷�ӦΪ���ȷ�Ӧ�������¶ȣ�ƽ�������ƶ���ƽ��ת��������ƽ�ⳣ�������¶ȴﵽ192��ʱ��ʮ����������Ũ������ƽ�������ƶ��������������������ӣ��ʴ�Ϊ����Ӧ���ȣ��¶����ߣ�ƽ�������ƶ������ͬʱ���¶����ߵ���ʮ����������Ũ������ƽ�������ƶ��������������������ӣ�
(3)���¶�335�棬��8 hʱ��ʮ����Ϊ1.00 mol�����C10H12��C10H8�IJ���x1=0.027��x2=0.374��������C10H12��C10H8�����ʵ����ֱ�Ϊ0.027mol��0.374mol���跴Ӧ��C10H18�����ʵ���Ϊa����ӦC10H12�����ʵ���Ϊb�����ݷ�Ӧ
C10H18(l)![]() C10H12(l)��3H2(g)
C10H12(l)��3H2(g)
1 1 3
a a 3a
C10H12(l)![]() C10H8(l)��2H2(g)��
C10H8(l)��2H2(g)��
1 1 2
b b 2b
��a-b=0.027��b=0.374����a=0.401��������ɵ����������ʵ�������Ϊ3a+2b=3��0.401+2��0.374=1.951������������Ϊ1.951mol���ʴ�Ϊ��1.951��
�ڷ�Ӧ2�Ļ�ܱȷ�Ӧ1С����ͬ�¶��·�Ӧ2���죬������ͬʱ���ڣ����ɵ��������ֶ�ת��Ϊ������x1��������x2���ʴ�Ϊ����Ӧ2�Ļ�ܱȷ�Ӧ1С����ͬ�¶��·�Ӧ2���죬������ͬʱ���ڣ����ɵ��������ֶ�ת��Ϊ������x1��������x2��
��C10H18(l)![]() C10H12(l)��3H2(g) ��H1��C10H12(l)
C10H12(l)��3H2(g) ��H1��C10H12(l)![]() C10H8(l)��2H2(g) ��H2����H1����H2��0��������Ӧ��Ϊ���ȷ�Ӧ������������������ڷ�Ӧ���C10H18��C10H12��C10H8��������������Ӧ������ ʾ��ͼΪ
C10H8(l)��2H2(g) ��H2����H1����H2��0��������Ӧ��Ϊ���ȷ�Ӧ������������������ڷ�Ӧ���C10H18��C10H12��C10H8��������������Ӧ������ ʾ��ͼΪ ���ʴ�Ϊ��
���ʴ�Ϊ�� ��
��
����(4)��H2O��N2Ϊԭ�ϣ�����NaOH��KOHΪ����ʣ�����Fe2O3����������250��ͳ�ѹ�¿�ʵ�ֵ绯ѧ�ϳɰ���������������ԭ��Ӧ����������һ����Ӧ2Fe��3H2O��N2��Fe2O3��2NH3����֪��Fe2O3������������ת��Ϊ������˵缫��ӦʽΪFe2O3+6e-+3H2O=2Fe+6OH-���ʴ�Ϊ��Fe2O3+6e-+3H2O=2Fe+6OH-��


 ������ʱͬ����ϰ��ϵ�д�
������ʱͬ����ϰ��ϵ�д� ѧҵ����һ��һ��ϵ�д�
ѧҵ����һ��һ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ÿ��10��23������6:02������6:02����Ϊ��Ħ����"(Mole Day),���ʱ�����ʽд��Ϊ6:0210/23������밢���ӵ�����6.02��1023���ơ�NAΪ�����ӵ�������ֵ������˵����ȷ����
A. ��״����22.4 LNO��11.2LO2 ��ַ�Ӧ������ķ�����ΪNA
B. 0.1mol/L��Na2SO4��Һ����SO42- ��Ŀ��0.1NA
C. ��״����.22.4L�������������۳�ַ�Ӧ,ת�Ƶĵ�����Ϊ3NA
D. 0.1molCH4�ĺ��������ΪNA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڢ�MgO��CuO��CaO��SO2;��C��Fe��S��P;��ZnCl2��BaCO3��HNO3��NaNO3����������,ÿ�����һ�������ڷ������������������ʲ�ͬ,���������ʷֱ���(����)
A. CuO��Fe��ZnCl2 B. SO2��S��NaNO3
C. CaO��C��BaCO3 D. SO2��Fe��HNO3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ȼ���S2Cl2����һ�ֻƺ�ɫҺ�壬�д̼��ԡ���Ϣ�Զ�����۵�Ϊ��80�棬�е�137.1�森�ڿ�����ǿ�ҷ��̣�����ˮ������Ӧ������ʹ����������ʹ�����ı��������ȷ�ճ�����Ӳ�IJ������ܣ������ڵ�����ͨ��������������S2Cl2 �� ��ͼ��ʵ������S��Cl2�Ʊ�S2Cl2��װ�ã��г�װ�á�����װ�þ�����ȥ���� 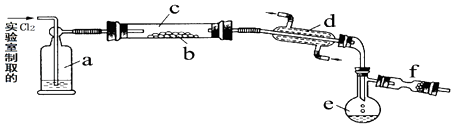
��1����֪S2Cl2���ӽṹ��H2O2���ƣ���д��S2Cl2�ĵ���ʽ ��
��2��װ��a��Ӧ���Լ�Ϊ �� ������Ϊ ��
��3����ʵ��IJ���˳��ӦΪ���ک�������ű�ʾ���� �ټ���װ��c ��ͨ��Cl2��ͨ����ˮ ��ֹͣͨCl2��ֹͣ����װ��c
��4��fװ����Ӧ���õ��Լ�Ϊ �� ������Ϊ ��
��5����֪S2Cl2��H2O��Ӧʱ��ֻ��һ��Ԫ�صĻ��ϼ۷����˱仯���ұ������ͱ���ԭ�ĸ�Ԫ�ص����ʵ���֮��Ϊ1��3����д���÷�Ӧ�Ļ�ѧ����ʽ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25��ʱ������(HM) ������(NaM) ��ɵĻ����Һ����ʼŨ�Ⱦ�Ϊ1mol/L�������Һ��ͨ��HCl��������NaOH����ʱ����ҺpH�ı仯������ͼ��ʾ������˵������ȷ����
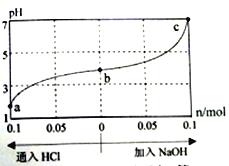
A. HM������ B. ����NaOH�����У� 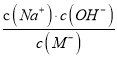 ��ֵ��С
��ֵ��С
C. c��ʱ����Һ��c(Na+)=c(M-) D. a��b��c��Ӧ��Һ�У�ˮ�ĵ���̶�: a<b<c
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ô�������Ӧ��SO2ת��ΪSO3�ǹ�ҵ����������Ĺؼ����衣��֪�� SO2��g�� ��1/2O2��g�� ![]() SO3��g�� ��H����98 kJ��mol�� 1��
SO3��g�� ��H����98 kJ��mol�� 1��
��1��ij�¶��¸÷�Ӧ��ƽ�ⳣ��K��10/3�����ڴ��¶��£���100 L�ĺ����ܱ������У�����3.0 mol SO2(g)��16.0 mol O2(g)��3.0 mol SO3(g)����Ӧ��ʼʱ v������_____v���棩������������������������������
��2��һ���¶��£���һ�����������Ϊ2 L���ܱ������г���2.0 mol SO2��1.0 mol O2���ﵽƽ��������Ϊ1.6 L����SO2��ƽ��ת����Ϊ____________ ��
��3���ڣ�2���еķ�Ӧ�ﵽƽ��ı�������������ʹSO2(g)ƽ��Ũ�ȱ�ԭ����С������______����
A�������¶Ⱥ�����������䣬����1.0 mol O2
B�������¶Ⱥ�������ѹǿ���䣬����1.0 mol SO3
C�������¶�
D���ƶ�����ѹ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й��ڱ���˵������ȷ����
A. ��������6��̼ԭ��֮��Ļ�ѧ����ȫ��ͬ
B. �������к���̼̼˫������ʹ���Ը��������Һ��ɫ
C. �ڴ��������£���������ˮ����ȡ����Ӧ�������屽
D. ����һ���ܶȱ�ˮ������ˮ����������ζ����ɫҺ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ��ģ��ֲ��Ĺ�����ã�������������̫���⡢ˮ��������̼(CO2)�ϳɼ���(CH4)���˹����ϵͳ,�乤��ԭ����ͼ��ʾ������˵����������� ��
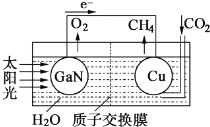
A. GaNΪ����,CuΪ���� B. ��װ����ֻ��������������ת��
C. GaN�缫�ĵ缫��ӦʽΪ2H2O-4e-=4H++O2�� D. ��װ�ù���ʱ,H+��Cu�缫�ƶ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڱ�״̬�£�1���ˮ�ܽ�700���������������Һ���ܶ���0.9g/cm3 �� ��
��1���ð�ˮ��Һ����������������ʾ����ˮ�е�����ΪNH3��
��2���ð�ˮ��Һ�����ʵ���Ũ�ȣ�
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com