
【题目】在①MgO、CuO、CaO、SO2;②C、Fe、S、P;③ZnCl2、BaCO3、HNO3、NaNO3三组物质中,每组各有一种物质在分类上与组内其他物质不同,这三种物质分别是( )
A. CuO、Fe、ZnCl2 B. SO2、S、NaNO3
C. CaO、C、BaCO3 D. SO2、Fe、HNO3
 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案科目:高中化学 来源: 题型:
【题目】下列两种物质发生反应 ①Na和O2②AlCl3与氨水 ③水玻璃与CO2④Fe与Cl2⑤Fe和稀HNO3,因反应物用量或反应条件的不同而生成不同产物的是( )
A.①②③④⑤B.①②③⑤C.①②⑤D.①③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前工业上合成氨的反应原理为:N2(g)+3H2(g) ![]() 2NH3(g) ΔH=-92.4 KJ/mol
2NH3(g) ΔH=-92.4 KJ/mol
(1)在恒温恒容条件下,向反应平衡体系中充入氮气,达到新平衡时,c(H2)将______(填“增大”、“减小”、“不变”或“无法判断”,下同),c(N2)·c(H2)将_______。
(2)下图为合成氨反应在不同温度和压强、使用相同催化剂条件下,初始时氮气、氢气的体积比为1:3时,平衡混合物中氨的体积分数。若分别用VA(NH3)和VB(NH3)表示从反应开始至达平衡状态A、B时的化学反应速率,则VA(NH3)_____VB(NH3)(填“>、“<”或“=")
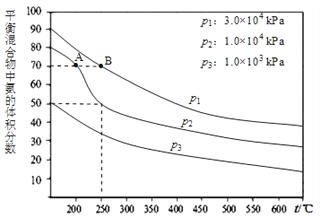
(3)①若恒温恒压下,在一容积可变的容器中,达到平衡状态时,N2、H2、NH3各1mol,若此时再充入3molN2,则平衡____移动(“向正向“向逆向”“不”);
②若氮气与氢气以1:1混合反应时,达到平衡后,如果升高温度氮气的体积分数将____(“变大”“变小”不变”下同);如果增大压强氮气的体积分数将___。
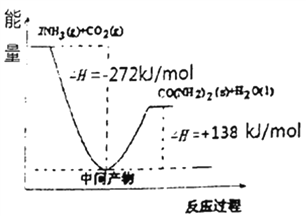
(4)H2NCOONH4是工业合成尿素的中间产物,该反应的能量变化如图所示:用CO2和氨合成尿素的热化学方程式为________。
(5)工业生产中逸出的氨可用稀硫酸吸收。若恰好生成NH4HSO4,该溶液中各离子的物质的量浓度由大到小的顺序是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产、生活密切相关,下列有关说法正确的是
A.葡萄糖注射液能产生丁达尔效应
B.高纯度的硅单质广泛用于制作光导纤维
C.二氧化硫的大量排放是造成光化学烟雾的主要原因
D.汽车的排气管上装有“催化转化器”,使有毒的CO和NO反应生成N2和CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W四种主族元素,它们在周期表中位置如图所示,下列说法正确的是
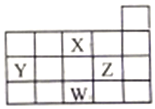
A. X、Y、Z三种元素的原子半径依次增大 B. X元素的氢化物稳定性比Y元素的弱
C. 化合物YZ4和氨气反应可以生成Y单项 D. 氢化物沸点: W>X
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.十氢萘是具有高储氢密度的氢能载体,经历“十氢萘(C10H18)→四氢萘(C10H12)→萘(C10H8)”的脱氢过程释放氢气。已知:
C10H18(l)![]() C10H12(l)+3H2(g) △H1
C10H12(l)+3H2(g) △H1
C10H12(l)![]() C10H8(l)+2H2(g) △H2
C10H8(l)+2H2(g) △H2
△H1>△H2>0;C10H18→C10H12的活化能为Ea1,C10H12→C10H8的活化能为Ea2,十氢萘的常压沸点为192℃;在192℃,液态十氢萘的脱氢反应的平衡转化率约为9%。请回答:
(1)有利于提高上述反应平衡转化率的条件是_________。
A.高温高压 B.低温低压 C.高温低压 D.低温高压
(2)研究表明,将适量的十萘奈置于恒容密闭反应器中,升高温度带来高压,该条件下也可显著释氢,理由是______________________________________________________。
(3)温度335℃,在恒容密闭反应器中进行高压液态十氢萘(1.00 mol)催化脱氢实验,测得C10H12和C10H8的产率x1和x2(以物质的量分数计)随时间变化关系,如图1所示。


①在8 h时,反应体系内氢气的量为__________mol(忽略其他副反应)。
②x1显著低于x2的原因是________________________________________。
③在图2中绘制“C10H18→C10H12→C10H8”的“能量~反应过程”示意图。
Ⅱ.科学家发现,以H2O和N2为原料,熔融NaOH-KOH为电解质,纳米Fe2O3作催化剂,在250℃和常压下可实现电化学合成氨。阴极区发生的变化可视为按两步进行,请补充完整。
(4)电极反应式:________________________________和2Fe+3H2O+N2=Fe2O3+2NH3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生探究0.25mol/L Al2( SO4)3溶液与0.5mol/L Na2CO3溶液的反应,实验如下:

下列分析不正确的是
A. 实验I中,白色沉淀a是Al(OH)3
B. 实验2中,白色沉淀b含有CO32-
C. 实验l、2中,白色沉淀成分不同的原因与混合后溶液的pH无关
D. 检验白色沉淀a、b足否洗涤干净,均可用盐酸酸化的BaCl2溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com