
【题目】近年来,我国许多城市禁止汽车使用含铅汽油,其主要原因是( )
A.提高汽油的燃烧效率
B.降低汽油成本
C.避免铅污染大气
D.铅资源短缺
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】表为元素周期表的一部分,请用化学用语回答有关问题:
族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | ① | ② | ||||||
3 | ⑨ | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
(1)①和⑧的元素符号是和;
(2)元素⑥形成的氢化物的电子式是;
(3)表中能形成两性氢氧化物的元素是(填写元素符号),请写出该元素的氢氧化物与⑨最高价氧化物对应的水化物发生反应的化学方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式写正确的是
A. 石灰石上滴加稀醋酸: CaCO3+2H+=Ca2++ H2O+CO2↑
B. 向沸水中滴加FeCl3溶液制Fe(OH)3胶体: Fe3++3H2O ![]() Fe(OH)3↓+ 3H+
Fe(OH)3↓+ 3H+
C. 少量SO2通入Ca(ClO)2溶液中: SO2+ H2O + Ca2++ 2ClO-= CaSO3↓+2HClO
D. 澄清石灰水与少量小苏打溶液混合: Ca2++ OH-+ HCO3-=CaCO3↓+ H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关材料用途的说法中不正确的是( )。
A.氧化铝陶瓷可用作高压钠灯的灯管
B.氮化硅陶瓷可用作陶瓷发动机的材料
C.光导纤维可用作遥测遥控、照明等
D.氧化铝陶瓷可用作半导体材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在①MgO、CuO、CaO、SO2;②C、Fe、S、P;③ZnCl2、BaCO3、HNO3、NaNO3三组物质中,每组各有一种物质在分类上与组内其他物质不同,这三种物质分别是( )
A. CuO、Fe、ZnCl2 B. SO2、S、NaNO3
C. CaO、C、BaCO3 D. SO2、Fe、HNO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2S 是一种大气污染物,工业上采取多种方法减少它的排放。
(1)工业上可采取生物脱H2S 方法减少H2S 的排放。生物脱H2S 的原理为:H2S + Fe2(SO4)3= S↓+ 2FeSO4 + H2SO4 4FeSO4 +O2 +2H2SO4 ![]() 2Fe2(SO4)3+2H2O
2Fe2(SO4)3+2H2O
试回答下列问题:
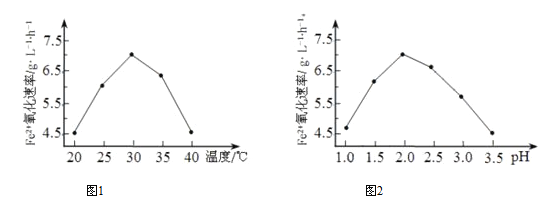
①硫杆菌存在时,FeSO4被氧化的速率是无菌时5.0×105倍,该菌的作用是_________。
②由下图1和图2 判断使用硫杆菌的最佳条件为_________。若反应温度过高,反应速率下降,其原因是____________。
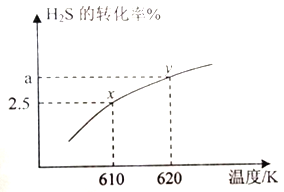
(2) 羰基硫(COS) 常在石化工业中用作在线仪表的校正气、标准气。其制备方法之一是H2S 与COS 在高温下发生反应: H2S(g)+CO2(g)![]() COS(g)+H2O(g) 在610K 时,将0.40mol H2S 与0.10molCO2充入2.5 L 的空钢瓶中,H2S的平衡转化率与温度的关系如图所示:
COS(g)+H2O(g) 在610K 时,将0.40mol H2S 与0.10molCO2充入2.5 L 的空钢瓶中,H2S的平衡转化率与温度的关系如图所示:
①下列说法能表明反应已达平衡状态的是__________。
A.H2S 和CO2的物质的量之比保持不变 B.混合气体的密度保持不变
C.混合气体的平均相对分子质量不再变化D.v逆(H2S)=V正(COS)
②该反应的△H______0.(填“>”“<”或“=”);x点对应温度下反应的平衡常数K=_____(保留两位有效数字)。
③在620K重复试验,若平衡后水的物质的量分数为0.030.则H2S 的转化率a=_____%。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化硫(S2Cl2)是一种黄红色液体,有刺激性、窒息性恶臭,熔点为﹣80℃,沸点137.1℃.在空气中强烈发烟,易与水发生反应.人们使用它作橡胶硫化剂使橡胶硫化,改变生橡胶受热发粘遇冷变硬的不良性能.在熔融的硫中通入氯气即可生成S2Cl2 . 下图是实验室用S和Cl2制备S2Cl2的装置(夹持装置、加热装置均已略去). 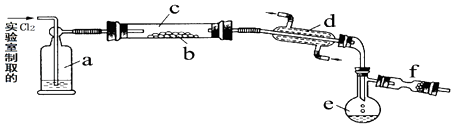
(1)已知S2Cl2分子结构与H2O2相似,请写出S2Cl2的电子式 .
(2)装置a中应放试剂为 , 其作用为 .
(3)该实验的操作顺序应为:②﹣(用序号表示). ①加热装置c ②通入Cl2③通冷凝水 ④停止通Cl2⑤停止加热装置c
(4)f装置中应放置的试剂为 , 其作用为 .
(5)已知S2Cl2与H2O反应时,只有一种元素的化合价发生了变化,且被氧化和被还原的该元素的物质的量之比为1:3,请写出该反应的化学方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤。已知: SO2(g) +1/2O2(g) ![]() SO3(g) △H=-98 kJ·mol- 1。
SO3(g) △H=-98 kJ·mol- 1。
(1)某温度下该反应的平衡常数K=10/3,若在此温度下,向100 L的恒容密闭容器中,充入3.0 mol SO2(g)、16.0 mol O2(g)和3.0 mol SO3(g),则反应开始时 v(正)_____v(逆)(填“<”、“>”或“=”)。
(2)一定温度下,向一带活塞的体积为2 L的密闭容器中充入2.0 mol SO2和1.0 mol O2,达到平衡后体积变为1.6 L,则SO2的平衡转化率为____________ 。
(3)在(2)中的反应达到平衡后,改变下列条件,能使SO2(g)平衡浓度比原来减小的是(______)。
A.保持温度和容器体积不变,充入1.0 mol O2
B.保持温度和容器内压强不变,充入1.0 mol SO3
C.降低温度
D.移动活塞压缩气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2015年国产C919大型客机正式下线,标志着我国成为世界上少数几个具有自行研制大型飞机的国家之一,标志着我国航空工业进入了新的发展阶段.
I. 飞机的外壳通常采用钛铝合金材料。
(1)基态Ti原子的价电子轨道表示式为__________。
(2)AlCl3在178℃时升华,其蒸气的相对分子质量约为267,蒸气分子的结构式为_______________________________ (标明配位键)。
(3)NaAlH4的释氢机理为:每3个AlH4-中,有2个分别释放出3个H原子和1个Al原子,同时与该Al原子最近邻的Na原子转移到被释放的Al原子留下的空位,形成新的结构。这种结构变化由表面层扩展到整个晶体,从而释放出氢气。该释氢过程可用化学方程式表示为__________________________________。
II. 现代飞机为了减轻质量而不减轻外壳承压能力,通常采用复合材料--玻璃纤维增强塑料,其成分之一为环氧树脂。
(4)常见的E51型环氧树脂中部分结构如下图所示:
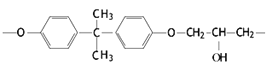
其中碳原子的杂化方式为________,它们的个数比为______。
III. 大型飞机的发动机被誉为航空工业皇冠上的“宝石”。制造过程中通常采用碳化钨做关键部位的材料
(5)钨元素位于周期表的第六周期第VIB族,已知该元素价电子不遵循半充满排布规律,请写出其外围电子排布式___________。
(6)下图为碳化钨晶体的一部分结构,碳原子嵌入金属钨的晶格的间隙,并不破坏原有金属的晶格,形成填隙+固溶体,也称为填隙化合物。在此结构中,其中钨原子有______个,1个钨原子周围距离钨原子最近的碳原子有____个,C原子填入钨原子组成的_____空隙。钨原子填入碳原子组成的_________空隙。下列金属元素的堆积方式与碳化钨晶胞中碳原子和钨原子所处位置类似的是______
A.FeCuB.TiAu C.MgZnD.CuAg
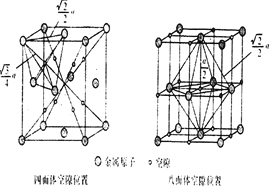
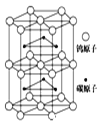
(7)假设该部分晶体的体积为Vcm3,碳化钨的摩尔质量为Mg/mol,密度为bg/cm3,则阿伏加德罗常数NA用上述数据可以表示为___________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com