
����Ŀ��Ԫ���ǹ������������������һ�����ʵġ�ԭ���ϡ���
��1����18������������ѧ���Dz���̽��Ԫ��֮�գ�ͨ���Ӿֲ���ϵͳ���о����̣�������Ԫ��֮���������ϵ�������г��˼�λ�ܳ���ѧ�ҵ��о�������
��� | �� | �� | �� | �� |
��ѧ�� | Ŧ���� | ������ | �±����� | �йŶ��� |
���� | ���֡������ɡ���ָ����ijһָ����Ԫ���𣬵ڰ˸�Ԫ���ǵ�һ��Ԫ�ص�ij���ظ� | ���� ����ԭ���ۣ����ȿ�ʼ���ԭ�������IJⶨ���� | ������5���������Ƶġ���Ԫ���顱���м�Ԫ�ص����ԭ������Ϊǰ������Ԫ�����ԭ������������ƽ��ֵ | ��Ϊ ��Ԫ����֮�䲢�Ǻ�����أ����������ԭ�����������ǰ���С�����˳���� |
������ѧ�ҵ��о�����ʱ���Ⱥ����������������������ţ���
��2��1869�꣬�Ž��з���ǰ���о��Ļ������Ƴ��˵�һ��Ԫ�����ڱ�����ͼ1��ʾ�� 
���Ž��з�����Ԫ�ذ������ԭ����������ͬһ������С������С���Ԫ���������ƣ���ϱ�����Ϣ�������4�з����С���=70�����ʺű���ĺ����� �� ��5�з����С�Te=128�������ʺű���ĺ����� ��
�ڵ�20���ͳ����Ž��з����ڱ���Ϊδ֪Ԫ�����µĿ�λ�����������ң�����ԭ�ӽṹ�����أ���ѧ���Ƿ�����Ԫ�����ʲ����������ԭ�������������������Ա仯����������ԭ���������˵�������������������Ա仯���䱾��ԭ����������ĸ��ţ���
A�����ź˵����������ԭ�Ӻ�������Ų����������Ա仯
B�����ź˵����������ԭ�Ӱ뾶���������Ա仯
C�����ź˵����������Ԫ����������ϼ۳��������Ա仯
��3�������е�Ԫ�����ڱ�����A,B,D,E,X��Y��Z���ֶ�����Ԫ�أ�X��Y����ͬһ���ڣ�Y������������ˮ������ǿ�ᡢǿ����ܷ�Ӧ��Z�ĵ��ʳ�����Ϊ��̬��ͬ������������������ܶȱ�Ϊ35.5��������Ϣ��ͼ2��ʾ�� ����������Ԫ���У����ڵڶ����ڵ�������Ԫ�ط��ű�ʾ����ͬ����X�����ڱ��е�λ���� ��
��E��ԭ�ӽṹʾ��ͼΪ �� д��ZԪ����̬�⻯��ĵ���ʽ�� ��
��B������E������������ˮ������һ�������·�����Ӧ�Ļ�ѧ����ʽΪ��Y������X������������ˮ������Һ��Ӧ�����ӷ���ʽΪ ��
��B��D������������ˮ����Ļ�ѧʽ�ֱ�Ϊ�� �� ��������ǰ�����ǿ�ڡ������ڡ������ߣ�ԭ����B��D�ķǽ������в��죬����ԭ�ӽṹ���Ͳ��������ԭ�� ��
���𰸡�
��1���ڢۢܢ�
��2�����У����ԭ������Ϊ70��Ԫ�أ�����Te�����ԭ����������128��A
��3��C��N���������ڣ��ڢ�A�壻![]() ��
��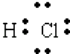 ��C+2H2SO4��Ũ��
��C+2H2SO4��Ũ�� ![]() CO2��+2SO2��+2H2O��2Al+2H2O+2OH���T2AlO2��+3H2����H2CO3��HNO3�����ڣ�Cԭ�Ӻ�Nԭ�Ӿ�����ͬ���Ӳ㣬Nԭ�ӵĺ˵��������C��Nԭ�Ӱ뾶С��C��Nԭ�Ӻ˶��������ӵ��������ô���C����N�ǽ�����ǿ��C
CO2��+2SO2��+2H2O��2Al+2H2O+2OH���T2AlO2��+3H2����H2CO3��HNO3�����ڣ�Cԭ�Ӻ�Nԭ�Ӿ�����ͬ���Ӳ㣬Nԭ�ӵĺ˵��������C��Nԭ�Ӱ뾶С��C��Nԭ�Ӻ˶��������ӵ��������ô���C����N�ǽ�����ǿ��C
���������⣺��1��1865�꣬Ŧ���ȷ��֡������ɡ���ָ����ijһָ����Ԫ���𣬵ڰ˸�Ԫ���ǵ�һ��Ԫ�ص�ij���ظ���1803�꣬�����ٴ��� ����ԭ���ۣ����ȿ�ʼ���ԭ�������IJⶨ������1829�꣬�±����ɷ�����5���������Ƶġ���Ԫ���顱���м�Ԫ�ص����ԭ������Ϊǰ������Ԫ�����ԭ������������ƽ��ֵ��1862�꣬�йŶ�����Ϊ ��Ԫ����֮�䲢�Ǻ�����أ����������ԭ�����������ǰ���С�����˳��������������ѧ�ҵ��о�����ʱ���Ⱥ�����������Ǣڢۢܢ٣����Դ��ǣ��ڢۢܢ٣���2���ٽ�ϱ�����Ϣ�ã���������Ԫ�ص����ԭ����������ͬһ����Ԫ���������ƣ���ϱ�����Ϣ�������4�з����С���=70�����ʺű���ĺ��������ԭ������Ϊ70��Ԫ�أ���Te=128��������Te�����ԭ����������128���ʵ�5�з����С�Te=128�������ʺű���ĺ����ǻ���Te�����ԭ����������128�����Դ��ǣ����У����ԭ������Ϊ70��Ԫ�أ�����Te�����ԭ����������128���ڿ�ѧ���Ƿ�����Ԫ�����ʲ����������ԭ�������������������Ա仯����������ԭ���������˵�������������������Ա仯���䱾��ԭ�������ź˵����������ԭ�Ӻ�������Ų����������Ա仯�����Դ��ǣ�A����3��Y������������ˮ������ǿ�ᡢǿ����ܷ�Ӧ����Y������Ԫ�����Ƕ�����Ԫ�أ���YΪAl��X��Y����ͬһ���ڣ���XΪ��������Ԫ�أ���X�����1�����ӣ���XΪNa��Z�ĵ��ʳ�����Ϊ��̬��ͬ������������������ܶȱ�Ϊ35.5����ZΪCl��ͬһ���ڴ����ң��뾶���μ�С����B��DΪ�ڶ�����Ԫ�أ�EΪ��������Ԫ�أ�B�����4�����ӣ���BΪC��D�����5�����ӣ���DΪN��E�����6�����ӣ���EΪS���ݴ˽��з���������������Ԫ���У����ڵڶ����ڵ���C��N��XΪNa�������ڱ��е�λ���ǵ������ڣ��ڢ�A�壻���Դ��ǣ�C��N���������ڣ��ڢ�A�壻��EΪS����ԭ�ӽṹʾ��ͼΪ ![]() ��ZΪCl������̬�⻯��ΪHCl��HCl��������1����ԭ�Ӻ�1����ԭ��ͨ������1�Ե��ӽ�϶��ɵĹ��ۻ����������ʽΪ
��ZΪCl������̬�⻯��ΪHCl��HCl��������1����ԭ�Ӻ�1����ԭ��ͨ������1�Ե��ӽ�϶��ɵĹ��ۻ����������ʽΪ 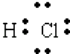 �����Դ��ǣ�
�����Դ��ǣ� ![]() ��
��  ����BΪC��E������������ˮ����ΪH2SO4 �� ��Ӧ���ɶ�����̼�����������ˮ���ʻ�ѧ����ʽΪC+2H2SO4��Ũ��
����BΪC��E������������ˮ����ΪH2SO4 �� ��Ӧ���ɶ�����̼�����������ˮ���ʻ�ѧ����ʽΪC+2H2SO4��Ũ�� ![]() CO2��+2SO2��+2H2O�� YΪAl��X������������ˮ����ΪNaOH����Ӧ����ƫ�����ƺ�ˮ���ʻ�ѧ����ʽΪ2Al+2H2O+2NaOH�T2NaAlO2+3H2������ǿ�ᣬǿ�������β𣬹����ӷ���ʽΪ2Al+2H2O+2OH���T2AlO2��+3H2�������Դ��ǣ�C+2H2SO4��Ũ��
CO2��+2SO2��+2H2O�� YΪAl��X������������ˮ����ΪNaOH����Ӧ����ƫ�����ƺ�ˮ���ʻ�ѧ����ʽΪ2Al+2H2O+2NaOH�T2NaAlO2+3H2������ǿ�ᣬǿ�������β𣬹����ӷ���ʽΪ2Al+2H2O+2OH���T2AlO2��+3H2�������Դ��ǣ�C+2H2SO4��Ũ�� ![]() CO2��+2SO2��+2H2O��2Al+2H2O+2OH���T2AlO2��+3H2������B��D������������ˮ����Ļ�ѧʽ�ֱ�ΪH2CO3��HNO3��̼�����Ա���������B��D�ķǽ������в��죬ԭ����Cԭ�Ӻ�Nԭ�Ӿ�����ͬ���Ӳ㣬Nԭ�ӵĺ˵��������C��Nԭ�Ӱ뾶С��C��Nԭ�Ӻ˶��������ӵ��������ô���C����N�ǽ�����ǿ��C�����Դ��ǣ�H2CO3��HNO3�����ڣ�Cԭ�Ӻ�Nԭ�Ӿ�����ͬ���Ӳ㣬Nԭ�ӵĺ˵��������C��Nԭ�Ӱ뾶С��C��Nԭ�Ӻ˶��������ӵ��������ô���C����N�ǽ�����ǿ��C��
CO2��+2SO2��+2H2O��2Al+2H2O+2OH���T2AlO2��+3H2������B��D������������ˮ����Ļ�ѧʽ�ֱ�ΪH2CO3��HNO3��̼�����Ա���������B��D�ķǽ������в��죬ԭ����Cԭ�Ӻ�Nԭ�Ӿ�����ͬ���Ӳ㣬Nԭ�ӵĺ˵��������C��Nԭ�Ӱ뾶С��C��Nԭ�Ӻ˶��������ӵ��������ô���C����N�ǽ�����ǿ��C�����Դ��ǣ�H2CO3��HNO3�����ڣ�Cԭ�Ӻ�Nԭ�Ӿ�����ͬ���Ӳ㣬Nԭ�ӵĺ˵��������C��Nԭ�Ӱ뾶С��C��Nԭ�Ӻ˶��������ӵ��������ô���C����N�ǽ�����ǿ��C��


 ͬ����ϰǿ����չϵ�д�
ͬ����ϰǿ����չϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����Ȼ��Ƽ���������״̬����е�⣬�ɵõ����������������˹�����
A.�ƻ��˽�����B.�ƻ��˹��ۼ�
C.�γ������Ӽ�D.�γ��˹��ۼ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ΪԪ�����ڱ���һ���֣����û�ѧ����ش��й����⣺
�� | ��A | ��A | ��A | ��A | ��A | ��A | ��A | 0 |
2 | �� | �� | ||||||
3 | �� | �� | �� | �� | �� | �� | �� |
��1���ٺ͢��Ԫ�ط���������
��2��Ԫ�آ��γɵ��⻯��ĵ���ʽ����
��3���������γ��������������Ԫ��������дԪ�ط��ţ�����д����Ԫ�ص����������������������Ӧ��ˮ�������Ӧ�Ļ�ѧ����ʽ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������У�����״���������������( )
A.P4
B.[SiO4]4��
C.CH4
D.CH3Cl
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ÿ��10��23������6:02������6:02����Ϊ��Ħ����"(Mole Day),���ʱ�����ʽд��Ϊ6:0210/23������밢���ӵ�����6.02��1023���ơ�NAΪ�����ӵ�������ֵ������˵����ȷ����
A. ��״����22.4 LNO��11.2LO2 ��ַ�Ӧ������ķ�����ΪNA
B. 0.1mol/L��Na2SO4��Һ����SO42- ��Ŀ��0.1NA
C. ��״����.22.4L�������������۳�ַ�Ӧ,ת�Ƶĵ�����Ϊ3NA
D. 0.1molCH4�ĺ��������ΪNA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������Ժ���չ�����ܵ���͵��ȡ������ʼ��仯����Ļ�ѧ�����������ơ�
��1����������ϡ��������,���ų�������д���������ᷴӦ�Ļ�ѧ����ʽ:_____________��
��2���ڸ��������������£�����NiC2O4ʹ��ֽ⣬���ܵõ�����ɫ������������д���÷�Ӧ�Ļ�ѧ����ʽ: _____________��
��3��Ni2O3������ˮ,���������Ტ�ų�������д���÷�Ӧ�����ӷ���ʽ: _____________��
��4�����������һ�ּ��Կɳ��������ȾС���������ϴ�������ص��ܷ�Ӧʽ��:H2+2NiO(OH) ![]() 2Ni(OH)2��д���ŵ�ʱ��������Ӧʽ: _____________��
2Ni(OH)2��д���ŵ�ʱ��������Ӧʽ: _____________��
��5�����ײ�������(Ni)��һ�ָ����ܵ缫���������Ʊ���������:
����I:ȡ0.2mol/L������������Һ������pH���������������̿���ˡ�
������:��������Һ�еμ�1.5mol/L��NaHCO3��ҺʹNi2+��ȫ����������:xNiCO3��yNi(OH)2��zH2O��
������:�������ij����ô����ߴ�ˮ��ϴ�������Ļ�˦�ɡ�
������:�����Թ���������Һ(N2H4��H2O)��ʹ����������ԭ��ȫ�������ɵ�Niˮϴ��������95%���Ҵ����ݺ����ɡ�Ϊ�ⶨxNiCO3��yNi(OH)2��zH2O���������������ʵ��:
��ȷ��ȡ7.54g��Ʒ�����������Һ(N2H4��H2O)��ַ�Ӧ�����ռ���1.12LN2��CO2�Ļ������(�ѻ���ɱ�״��)��
����ȡ����������Ʒ������գ���ȴ��Ƶò�������NiO������Ϊ4.5g��
ͨ������ȷ��xNiCO3��yNi(OH)2��zH2O�Ļ�ѧʽ_______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ӷ���ʽд��ȷ����
A. ʯ��ʯ�ϵμ�ϡ����: CaCO3+2H+=Ca2++ H2O+CO2��
B. ���ˮ�еμ�FeCl3��Һ��Fe(OH)3����: Fe3++3H2O ![]() Fe(OH)3��+ 3H+
Fe(OH)3��+ 3H+
C. ����SO2ͨ��Ca(ClO)2��Һ��: SO2+ H2O + Ca2++ 2ClO-= CaSO3��+2HClO
D. ����ʯ��ˮ������С�մ���Һ���: Ca2++ OH-+ HCO3-=CaCO3��+ H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���йز�����;��˵���в���ȷ����( )��
A.�������մɿ�������ѹ�ƵƵĵƹ�
B.�������մɿ������մɷ������IJ���
C.���ά������ң��ң�ء�������
D.�������մɿ������뵼�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ô�������Ӧ��SO2ת��ΪSO3�ǹ�ҵ����������Ĺؼ����衣��֪�� SO2��g�� ��1/2O2��g�� ![]() SO3��g�� ��H����98 kJ��mol�� 1��
SO3��g�� ��H����98 kJ��mol�� 1��
��1��ij�¶��¸÷�Ӧ��ƽ�ⳣ��K��10/3�����ڴ��¶��£���100 L�ĺ����ܱ������У�����3.0 mol SO2(g)��16.0 mol O2(g)��3.0 mol SO3(g)����Ӧ��ʼʱ v������_____v���棩������������������������������
��2��һ���¶��£���һ�����������Ϊ2 L���ܱ������г���2.0 mol SO2��1.0 mol O2���ﵽƽ��������Ϊ1.6 L����SO2��ƽ��ת����Ϊ____________ ��
��3���ڣ�2���еķ�Ӧ�ﵽƽ��ı�������������ʹSO2(g)ƽ��Ũ�ȱ�ԭ����С������______����
A�������¶Ⱥ�����������䣬����1.0 mol O2
B�������¶Ⱥ�������ѹǿ���䣬����1.0 mol SO3
C�������¶�
D���ƶ�����ѹ������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com