


| ||
| ||
| ||
| ||


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| A、Cu片、Al片 |
| B、Al片、Cu片 |
| C、Al片、Al片 |
| D、Cu片、Cu片 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、中和pH和体积都相同的盐酸和醋酸,消耗NaOH的物质的量之比为l:l |
| B、pH=3的盐酸和pH=3的FeCl3溶液中,水电离的c(H+)相等 |
| C、0.1 mol?L-NaHC03溶液中:c(Na+)>c(HCO3-)>c(CO32一)>c(H2C03) |
| D、浓度均为0.1 mol/L的三种溶液:①CH3COOH溶液;②NaOH溶液;⑧CH3COONa溶液,溶液的PH ②>③>① |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 催化剂 |
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO) | 1.00×10-3 | 4.50×10-4 | 2.50×10-4 | 1.50×10-4 | 1.00×10-4 | 1.00×10-4 |
| c(CO) | 3.60×10-3 | 3.05×10-3 | 2.85×10-3 | 2.75×10-3 | 2.70×10-3 | 2.70×10-3 |
| 实验编号 | T/℃ | NO初始浓度 | CO初始浓度 | 催化剂比表面积/m2?g-1 |
| Ⅰ | 280 | 1.20×10-3 | 5.80×10-3 | 82 |
| Ⅱ | 124 | |||
| Ⅲ | 350 | 124 |
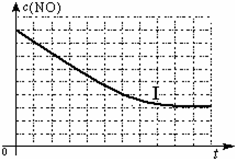
查看答案和解析>>
科目:高中化学 来源: 题型:
| H+/H2O |
| 反应① |
 +
+
 ),则试剂X是
),则试剂X是查看答案和解析>>
科目:高中化学 来源: 题型:
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 某同学为了探究不同条件下铁钉的锈蚀情况,设计了如下实验:
某同学为了探究不同条件下铁钉的锈蚀情况,设计了如下实验:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com