
| H+/H2O |
| 反应① |
 +
+
 ),则试剂X是
),则试剂X是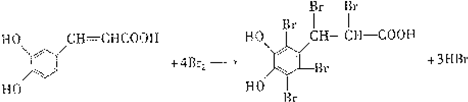 ,
, ;
;

科目:高中化学 来源: 题型:
| A、可用水来鉴别汽油、四氯化碳和乙酸 |
| B、欲除去乙烷气体中混有的乙烯,在镍粉催化条件下通入适量氢气 |
| C、除去溴苯中红棕色的溴,可用稀NaOH溶液洗涤,并用分液漏斗分液 |
| D、室温下向苯和少量苯酚的混合溶液中加入适量NaOH溶液,振荡、静置后分液,可除去苯中少量苯酚 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、钠、钾着火时可用水灭火 |
| B、面粉厂或加油站不必严禁烟火 |
| C、氨气泄漏时可喷洒大量水进行处理 |
| D、节日期间可在人群聚集的闹市燃放烟花爆竹 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
| 开始沉淀时 | 3.4 | 6.3 | 1.5 |
| 完全沉淀时 | 4.7 | 8.3 | 2.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
 一定温度下,向某容器固定的密闭容器中加入适量(NH4)2S固体,发生如下反应:
一定温度下,向某容器固定的密闭容器中加入适量(NH4)2S固体,发生如下反应:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com