
【题目】分子式为C5H11Cl的卤代烃,其分子中含有两个—CH3、两个—CH2—、一个![]() 和一个—Cl,它可能的结构有( )
和一个—Cl,它可能的结构有( )
A.2种B.3种C.4种D.5种
【答案】C
【解析】
戊烷的同分异构体有CH3-CH2-CH2-CH2-CH3、![]() 、
、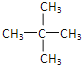 ;
;
若为CH3-CH2-CH2-CH2-CH3,一氯代物有:CH3CH2CH2CH2CH2Cl;CH3CH2CH2CHClCH3;CH3CH2CHClCH2CH3;其中CH3CH2CH2CHClCH3;CH3CH2CHClCH2CH3符合条件;
若为![]() ,一氯代物有:CH3CH(CH3)CH2CH2Cl;CH3CH(CH3)CHClCH3;CH3CCl(CH3)CH2CH3; CH2ClCH(CH3)CH2CH3;其中CH3CH(CH3)CH2CH2Cl;CH2ClCH(CH3)CH2CH3符合条件;
,一氯代物有:CH3CH(CH3)CH2CH2Cl;CH3CH(CH3)CHClCH3;CH3CCl(CH3)CH2CH3; CH2ClCH(CH3)CH2CH3;其中CH3CH(CH3)CH2CH2Cl;CH2ClCH(CH3)CH2CH3符合条件;
若为 ,一氯代物:CH3C(CH3)2CH2Cl,不符合条件;
,一氯代物:CH3C(CH3)2CH2Cl,不符合条件;
故符合条件有4种;
故答案选C。


科目:高中化学 来源: 题型:
【题目】已知3.0g乙烷C2H6完全燃烧在常温下放出的热量为156kJ,则下列表示乙烷燃烧热的热化学方程式书写正确的是( )
A. 2C2H6(g)+7O2(g)=4CO2(g)+6H2O(g) △H=-3120kJ/mol
B. C2H6(g)+ ![]() O2(g)=2CO2(g)+3H2O(g) △H=-1560kJ/mol
O2(g)=2CO2(g)+3H2O(g) △H=-1560kJ/mol
C. C2H6(g)+ ![]() O2(g)=2CO2(g)+3H2O(g) △H=-1560kJ/mol
O2(g)=2CO2(g)+3H2O(g) △H=-1560kJ/mol
D. C2H6(g)+ ![]() O2(g)=2CO2(g)+3H2O(1) △H=-1560kJ/mol
O2(g)=2CO2(g)+3H2O(1) △H=-1560kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是“足球稀”分子中含有12个五边形,20个六边形,30个双键。

(1)平均每个五边形所含碳原子为______个,平均每个六边形所含的碳原子为_________个。
(2)“足球烯”分子的分子式为___________。
(3)“足球烯”分子含有的化学键单键数为___________。
(4)若某“足球烯”分子含12个正五边,25个正六边形,则其分子式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列3种有机化合物A:CH2=CH2、 B:![]() 、 C:CH3COOH
、 C:CH3COOH
(1)写出化合物A、C中官能团的名称______、_____;
(2)3种化合物中能使溴的四氯化碳溶液褪色的是_____(写名称);反应的化学方程式为:________________;具有特殊气味、常做有机溶剂的是____(写结构简式)。
(3)3种化合物中能与乙醇发生酯化反应的是______(写名称);反应的化学方程式为:____________;反应类型为:___ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在一个2 L的密闭容器中,加入4 mol A和2 mol B发生反应:
3A(g)+2B(g)![]() 4C(s)+2D(g),5min后达到平衡,测得生成1.6 mol C,则下列说法正确的是
4C(s)+2D(g),5min后达到平衡,测得生成1.6 mol C,则下列说法正确的是
A. 该反应的化学平衡常数表达式是K=![]()
B. 此时,B的平衡转化率是40%
C. 增大该体系的压强,平衡向右移动,化学平衡常数增大
D. 若向平衡体系中加入少量C,则正、逆反应速率均增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于热化学反应的描述中正确的是( )
A.HCl与NaOH反应的中和热△H=-57.3kJ/mol,则H2SO4和氨水反应的中和热△H=2×(-57.3)kJ/mol
B.CO(g)的燃烧热是283.0kJ/mol,则2CO2(g)=2CO(g)+O2(g)的反应热△H=+566.0kJ/mol
C.需要加热才能发生的反应一定是吸热反应
D.1mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上生产MnO2和Zn的主要反应有:
①MnO2+ZnS+2H2SO4=MnSO4+ZnSO4+S+2H2O
②MnSO4+ZnSO4+2H2O![]() MnO2+Zn+2H2SO4 下列说法不正确的是( )
MnO2+Zn+2H2SO4 下列说法不正确的是( )
A.H2SO4氧化性大于MnO2B.①中析出16 g S时转移l mol电子
C.②反应电解时阴极上Zn2+先放电D.硫酸在该生产中可循环利用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】联氨(又称联肼,N2H4,无色液体)是一种应用广泛的化工原料,可用作火箭燃料,回答下列问题:
(1)联氨分子的电子式为_____________,其中氮的化合价为____________。
(2)实验室可用次氯酸钠溶液与氨反应制备联氨,反应的化学方程式为___________。
(3)①2O2(g)+N2(g)=N2O4(l) △H1
②N2(g)+2H2(g)=N2H4(l) △H2
③O2(g)+2H2(g)=2H2O(g) △H3
④2 N2H4(l) + N2O4(l)= 3N2(g)+ 4H2O(g) △H4=-1048.9kJ/mol
上述反应热效应之间的关系式为△H4=________________,联氨和N2O4可作为火箭推进剂的主要原因为_________________________________________________。
(4)联氨为二元弱碱,在水中的电离方程式与氨相似,联氨第一步电离反应的平衡常数值为___________________(已知:N2H4+H+![]() N2H5+的K=8.7×107;KW=1.0×10-14)。联氨与硫酸形成的酸式盐的化学式为 。
N2H5+的K=8.7×107;KW=1.0×10-14)。联氨与硫酸形成的酸式盐的化学式为 。
(5)联氨是一种常用的还原剂。向装有少量AgBr的试管中加入联氨溶液,观察到的现象是。联氨可用于处理高压锅炉水中的氧,防止锅炉被腐蚀。理论上1kg的联氨可除去水中溶解的O2kg;与使用Na2SO3处理水中溶解的O2相比,联氨的优点是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某结晶水合物的化学式为A·nH2O,其相对分子质量为M,在25℃时,ag晶体溶于bg水中即达饱和,形成密度为ρg/mL的溶液,下列表达式正确的是( )
A.饱和溶液的物质的量浓度为:![]() mol/L
mol/L
B.饱和溶液中溶质的质量分数为:![]() %
%
C.饱和溶液的体积为:![]() L
L
D.25℃时,A的溶解度为:![]() g
g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com