
【题目】工业上生产MnO2和Zn的主要反应有:
①MnO2+ZnS+2H2SO4=MnSO4+ZnSO4+S+2H2O
②MnSO4+ZnSO4+2H2O![]() MnO2+Zn+2H2SO4 下列说法不正确的是( )
MnO2+Zn+2H2SO4 下列说法不正确的是( )
A.H2SO4氧化性大于MnO2B.①中析出16 g S时转移l mol电子
C.②反应电解时阴极上Zn2+先放电D.硫酸在该生产中可循环利用
【答案】A
【解析】
A. 由MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O可知物质的氧化性:MnO2>Cl2,由Cl2+SO2+2H2O=H2SO4+2HCl可知物质的氧化性:Cl2>H2SO4,所以物质的氧化性:MnO2>Cl2>H2SO4,A错误;
MnCl2+Cl2↑+2H2O可知物质的氧化性:MnO2>Cl2,由Cl2+SO2+2H2O=H2SO4+2HCl可知物质的氧化性:Cl2>H2SO4,所以物质的氧化性:MnO2>Cl2>H2SO4,A错误;
B. 根据①方程式可知:每反应产生1 mol S单质,转移2 mol电子,16 g S的物质的量是0.5 mol,则反应转移电子的物质的量为1 mol,B正确;
C. 根据②方程式可知电解时阴极上Zn2+得到电子变为Zn单质,C正确;
D. 反应①中消耗硫酸,反应②产生硫酸,所以硫酸在该生产中可循环利用,D正确;
故合理选项是A。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】由NO2、O2、熔融盐NaNO3组成的燃料电池如图所示,在使用过程中石墨Ⅰ电极反应生成一种氧化物Y,下列有关说法正确的是( )
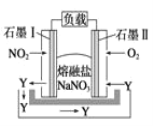
A. 石墨Ⅰ极为正极,石墨Ⅱ极为负极
B. Y的化学式可能为NO
C. 石墨Ⅰ极的电极反应式为NO2+NO3--e-===N2O5
D. 石墨Ⅱ极上发生氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分子式为C5H11Cl的卤代烃,其分子中含有两个—CH3、两个—CH2—、一个![]() 和一个—Cl,它可能的结构有( )
和一个—Cl,它可能的结构有( )
A.2种B.3种C.4种D.5种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①2H2O(g)===2H2(g)+O2(g) ΔH=+483.6 kJ·mol-1 ②H2S(g)===H2(g)+S(g) ΔH=+20.1 kJ·mol-1下列判断正确的是( )
A. 氢气的燃烧热:ΔH=-241.8 kJ·mol-1
B. 相同条件下,充分燃烧1 mol H2(g)与1 mol S(g)的混合物比充分燃烧1 mol H2S(g)放热多20.1 kJ
C. 由①②知,水的热稳定性小于硫化氢
D. ②中若生成固态硫,ΔH将增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通常人们把拆开1 mol某化学键所消耗的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热(△H),化学反应的△H等于反应物的总键能与生成物的总键能之差。
化学键 | Si—O | Si—Cl | H—H | H—Cl | Si—Si | Si—C |
键能/kJ·mol-1 | 46 | 360 | 436 | 431 | 176 | 347 |
工业上高纯硅可通过下列反应制取:SiCl4(g)+2H2(g)![]() Si(s)+4HCl(g),该反应的反应热△H为 ( )
Si(s)+4HCl(g),该反应的反应热△H为 ( )
A.+412 kJ·mol-1B.-412 kJ·mol-1
C.+236 kJ·mol-1D.-236 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法或表示方法正确的是( )
A. 等物质的量的硫蒸气和固体硫分别完全燃烧,前者放出热量多
B. 由C(石墨)=C(金刚石) △H =+1.90 kJ/mol可知,金刚石比石墨稳定
C. 在101kPa时,2g氢气完全燃烧生成液态水,放出285.8kJ热量,则氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)= 2H2O(l) △H=-285.8kJ/mol
D. 2N2O5(g)![]() 4NO2(g)+O2(g) ΔH>0 反应为熵增反应,任何温度下能自发进行
4NO2(g)+O2(g) ΔH>0 反应为熵增反应,任何温度下能自发进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于“最多”“最少”的说法中不正确的是( )。
A.在盐酸与氢氧化钠溶液的中和热测定的实验过程中,最少需要测定并记录温度的次数是3次
B.在硫酸铜晶体中结晶水含量测定的实验中,在实验过程中最少称量4次
C.在某有机物分子中含n个—CH2—,m个![]() ,a个—CH3,其余为羟基,则含羟基的个数最多为m - a + 2
,a个—CH3,其余为羟基,则含羟基的个数最多为m - a + 2
D.在有机物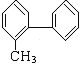 分子中处于同一平面内的碳原子数最多有13个
分子中处于同一平面内的碳原子数最多有13个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上以软锰矿(主要成分为MnO2,另含有少量FeCO3、Al2O3、SiO2)为原料制取金属锰的工艺流程如下:
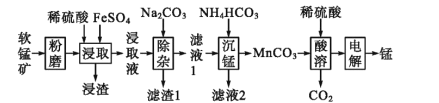
(1)写出“浸渣”中主要成分的用途 ________(写出两条)。
(2)滤渣1的主要成分是 ________(用化学式表示)
(3)经检测“浸取液”中无Fe2+,“浸取”时MnO 2发生反应的离子方程式为 ________。
(4)写出“沉锰”操作中发生反应的离子方程式:________。
(5)将“酸溶”后的溶液作为电解液,用下图1装置电解,应采用 ______(填“阴”或“阳”)离子交换膜,阳极的电极反应式为________。
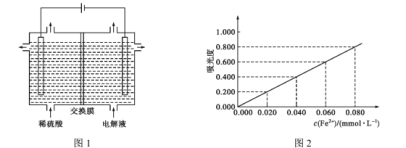
(6)为充分利用“滤渣1”,需测定滤渣中铝元素的含量,设计以下方案。
①将ag滤渣处理成xmL溶液。
②取少量①中溶液用EDTA滴定测得溶液中Fe3+ 、Al3+ 的浓度之和为ymmol·L-1 。
③另取少量①中溶液将Fe3+ 用盐酸羟胺(在溶液中可完全电离出NH3OH+与Cl- )还原为Fe2+,离子方程式为 ________;
④将③所得溶液利用吸光度法测得其吸光度为0.400(吸光度与Fe2+的浓度关系如上图2所示)。该样品中铝元素的质量分数为 _________(用含字母的表达式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com