
【题目】下列关于“最多”“最少”的说法中不正确的是( )。
A.在盐酸与氢氧化钠溶液的中和热测定的实验过程中,最少需要测定并记录温度的次数是3次
B.在硫酸铜晶体中结晶水含量测定的实验中,在实验过程中最少称量4次
C.在某有机物分子中含n个—CH2—,m个![]() ,a个—CH3,其余为羟基,则含羟基的个数最多为m - a + 2
,a个—CH3,其余为羟基,则含羟基的个数最多为m - a + 2
D.在有机物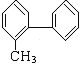 分子中处于同一平面内的碳原子数最多有13个
分子中处于同一平面内的碳原子数最多有13个
【答案】A
【解析】
A. 在盐酸与氢氧化钠溶液的中和热测定的实验过程中,要量取盐酸的温度、量氢氧化钠溶液的温度、量混合后反应体系的最高温度,每次实验最少需要测定并记录温度的次数是3次,但为了减少偶尔误差保证实验准确,要做平行实验,重复做2到3次,A错误;
B.硫酸铜晶体中结晶水含量的测定”的实验步骤如下:(a)研磨:在研钵中将硫酸铜晶体研碎.(防止加热时可能发生迸溅)(b)称量:准确称量一干燥洁净的瓷坩锅质量(c)再称:称量瓷坩埚+硫酸铜晶体的质量(d)加热:小火缓慢加热至蓝色晶体全部变为白色粉末,并放入干燥器中冷却(e)再称:在干燥器内冷却后,称量瓷坩埚+硫酸铜粉末的质量,(f)再加热:把盛有硫酸铜的瓷坩埚再加热,再冷却(g)再称量:将冷却后的盛有硫酸铜的瓷坩埚再次称量,并再次重复加热和称量步骤,直至两次称量误差小于0.1g为止,因此在实验过程中最少称量4次,B正确;
C. 在某有机物分子中含n个—CH2—,m个![]() ,a个—CH3,其余为羟基, -OH数与—CH2—个数无关,若没有
,a个—CH3,其余为羟基, -OH数与—CH2—个数无关,若没有![]() ,则只有两个端点,增加一个
,则只有两个端点,增加一个![]() 就会产生一个支链即增加一个端点,端点只能是—CH3或-OH,端点基团的总个数=支链个数+2可得:a+x=m+2,x=m+2-a,C正确;
就会产生一个支链即增加一个端点,端点只能是—CH3或-OH,端点基团的总个数=支链个数+2可得:a+x=m+2,x=m+2-a,C正确;
D.两个苯环之间的碳碳单键可以旋转,当有机物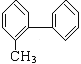 分子中2个苯环处于同一平面时,13个碳原子都在同一平面上,D正确;
分子中2个苯环处于同一平面时,13个碳原子都在同一平面上,D正确;
答案选A。


科目:高中化学 来源: 题型:
【题目】如图所示是“足球稀”分子中含有12个五边形,20个六边形,30个双键。

(1)平均每个五边形所含碳原子为______个,平均每个六边形所含的碳原子为_________个。
(2)“足球烯”分子的分子式为___________。
(3)“足球烯”分子含有的化学键单键数为___________。
(4)若某“足球烯”分子含12个正五边,25个正六边形,则其分子式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上生产MnO2和Zn的主要反应有:
①MnO2+ZnS+2H2SO4=MnSO4+ZnSO4+S+2H2O
②MnSO4+ZnSO4+2H2O![]() MnO2+Zn+2H2SO4 下列说法不正确的是( )
MnO2+Zn+2H2SO4 下列说法不正确的是( )
A.H2SO4氧化性大于MnO2B.①中析出16 g S时转移l mol电子
C.②反应电解时阴极上Zn2+先放电D.硫酸在该生产中可循环利用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】联氨(又称联肼,N2H4,无色液体)是一种应用广泛的化工原料,可用作火箭燃料,回答下列问题:
(1)联氨分子的电子式为_____________,其中氮的化合价为____________。
(2)实验室可用次氯酸钠溶液与氨反应制备联氨,反应的化学方程式为___________。
(3)①2O2(g)+N2(g)=N2O4(l) △H1
②N2(g)+2H2(g)=N2H4(l) △H2
③O2(g)+2H2(g)=2H2O(g) △H3
④2 N2H4(l) + N2O4(l)= 3N2(g)+ 4H2O(g) △H4=-1048.9kJ/mol
上述反应热效应之间的关系式为△H4=________________,联氨和N2O4可作为火箭推进剂的主要原因为_________________________________________________。
(4)联氨为二元弱碱,在水中的电离方程式与氨相似,联氨第一步电离反应的平衡常数值为___________________(已知:N2H4+H+![]() N2H5+的K=8.7×107;KW=1.0×10-14)。联氨与硫酸形成的酸式盐的化学式为 。
N2H5+的K=8.7×107;KW=1.0×10-14)。联氨与硫酸形成的酸式盐的化学式为 。
(5)联氨是一种常用的还原剂。向装有少量AgBr的试管中加入联氨溶液,观察到的现象是。联氨可用于处理高压锅炉水中的氧,防止锅炉被腐蚀。理论上1kg的联氨可除去水中溶解的O2kg;与使用Na2SO3处理水中溶解的O2相比,联氨的优点是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组,为研究光化学烟雾消长规律,在一烟雾实验箱中,测得烟雾的主要成分为RH(烃)、NO、NO2、O3、PAN(CH3COOONO2),各种物质的相对浓度随时间的消失,记录于下图,根据图中数据,下列推论最不合理的是
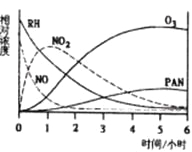
A.NO的消失的速率比RH快
B.NO转化为NO2
C.RH和NO2转化为PAN和O3
D.O3转化为PAN
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Cu2O是一种半导体材料,基于绿色化学理念设计的制取Cu2O的电解池示意图如右图所示,电解总反应为:2Cu+H2O![]() Cu2O+H2↑。下列说法正确的是
Cu2O+H2↑。下列说法正确的是

A. 铜电极发生还原反应 B. 石墨电极上产生氢气
C. 铜电极接直流电源的负极 D. 当有0.1 mol电子转移时,有0.1 mol Cu2O生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,在25mL 0.1mol·L-1 NaOH溶液中,逐滴加入0.2mol·L-1 CH3COOH溶液,溶液pH的变化曲线如下图所示。下列分析中正确的是( )
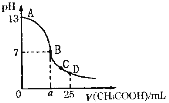
A.C点c(CH3COO—)>c(Na+)>c(H+)>c(OH—)
B.B点的横坐标a=12.5
C.D点c(CH3COO—)+c(CH3COOH)=c(Na+)
D.曲线上A、B间任一点,溶液中都有:c(Na+)>c(CH3COO—)>c(OH—)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某结晶水合物的化学式为A·nH2O,其相对分子质量为M,在25℃时,ag晶体溶于bg水中即达饱和,形成密度为ρg/mL的溶液,下列表达式正确的是( )
A.饱和溶液的物质的量浓度为:![]() mol/L
mol/L
B.饱和溶液中溶质的质量分数为:![]() %
%
C.饱和溶液的体积为:![]() L
L
D.25℃时,A的溶解度为:![]() g
g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列六种物质的溶液:①Na2CO3 ②Al2(SO4)3 ③CH3COOH ④NaHCO3 ⑤HCl ⑥Al(OH)3
(1)pH值相同的③和⑤,分别用蒸馏水稀释至原来的![]() 倍和
倍和![]() 倍,稀释后两溶液的
倍,稀释后两溶液的![]() 值仍然相同,则
值仍然相同,则![]() ______
______![]() (填“<”或“>”或“=”)
(填“<”或“>”或“=”)
(2)室温下,![]() 值为11的①溶液中,由水电离出来的c(OH—)=______
值为11的①溶液中,由水电离出来的c(OH—)=______
(3)写出①溶液的电荷守恒:____________。
(4)写出⑥的酸式电离方程式:________________
(5)用②和④的溶液可以制作泡沫灭火剂,其原理为:________________(用离子方程式解释)
(6)已知反应NH4++HCO3-+H2ONH3·H2O+H2CO3,该反应平衡常数K=_____。(已知常温下NH3·H2O的电离平衡常数Kb=2×10-5,H2CO3的电离平衡常数Ka1=4×10-7,Ka2=4×10-11)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com