
【题目】某研究性学习小组,为研究光化学烟雾消长规律,在一烟雾实验箱中,测得烟雾的主要成分为RH(烃)、NO、NO2、O3、PAN(CH3COOONO2),各种物质的相对浓度随时间的消失,记录于下图,根据图中数据,下列推论最不合理的是
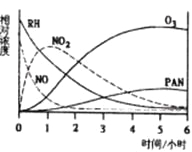
A.NO的消失的速率比RH快
B.NO转化为NO2
C.RH和NO2转化为PAN和O3
D.O3转化为PAN
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】萘、四氢萘、十氢萘用途广泛,其转化关系为: ,该过程中能量变化如图所示,下列说法不正确的是:
,该过程中能量变化如图所示,下列说法不正确的是:

A.萘分子(![]() )的一氯代物有2种
)的一氯代物有2种
B.实线表示无催化剂的反应过程,虚线表示有催化剂的反应过程
C.E1、E2表示活化能,a的大小由E1决定,b的大小由E2决定
D.物质的稳定性:十氢萘>四氢萘>萘
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①2H2O(g)===2H2(g)+O2(g) ΔH=+483.6 kJ·mol-1 ②H2S(g)===H2(g)+S(g) ΔH=+20.1 kJ·mol-1下列判断正确的是( )
A. 氢气的燃烧热:ΔH=-241.8 kJ·mol-1
B. 相同条件下,充分燃烧1 mol H2(g)与1 mol S(g)的混合物比充分燃烧1 mol H2S(g)放热多20.1 kJ
C. 由①②知,水的热稳定性小于硫化氢
D. ②中若生成固态硫,ΔH将增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法或表示方法正确的是( )
A. 等物质的量的硫蒸气和固体硫分别完全燃烧,前者放出热量多
B. 由C(石墨)=C(金刚石) △H =+1.90 kJ/mol可知,金刚石比石墨稳定
C. 在101kPa时,2g氢气完全燃烧生成液态水,放出285.8kJ热量,则氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)= 2H2O(l) △H=-285.8kJ/mol
D. 2N2O5(g)![]() 4NO2(g)+O2(g) ΔH>0 反应为熵增反应,任何温度下能自发进行
4NO2(g)+O2(g) ΔH>0 反应为熵增反应,任何温度下能自发进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】参考下列图表和有关要求回答问题:

(1)图Ⅰ是1 mol NO2(g)和1 mol CO(g)反应生成CO2和NO过程中能量变化示意图,若在反应体系中加入催化剂,反应速率增大,E2的变化是________(填“增大”“减小”或“不变”,下同),ΔH的变化是________。请写出NO2和CO反应的热化学方程式:_________。
(2)甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是:
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g) ΔH=+49.0 kJ·mol-1
②CH3OH(g)+![]() O2(g)=CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
O2(g)=CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
又知③H2O(g)=H2O(l) ΔH=-44 kJ·mol-1
则甲醇燃烧生成液态水的热化学方程式:____________________________________。
(3)下表是部分化学键的键能数据:
化学键 | P—P | P—O | O=O | P=O |
键能(kJ·mol-1) | 198 | 360 | 498 | x |
已知1 mol白磷(P4)完全燃烧放热为1194kJ,白磷及其完全燃烧的产物结构如图Ⅱ所示,则表中x=________ kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于“最多”“最少”的说法中不正确的是( )。
A.在盐酸与氢氧化钠溶液的中和热测定的实验过程中,最少需要测定并记录温度的次数是3次
B.在硫酸铜晶体中结晶水含量测定的实验中,在实验过程中最少称量4次
C.在某有机物分子中含n个—CH2—,m个![]() ,a个—CH3,其余为羟基,则含羟基的个数最多为m - a + 2
,a个—CH3,其余为羟基,则含羟基的个数最多为m - a + 2
D.在有机物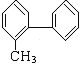 分子中处于同一平面内的碳原子数最多有13个
分子中处于同一平面内的碳原子数最多有13个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下向10mL pH=3的醋酸溶液中加入水稀释后,下列说法正确的是
A. 溶液中导电粒子的数目减少
B. 溶液中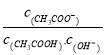 不变
不变
C. 醋酸的电离程度增大,C(H+)亦增大
D. 再加入10mlpH=11的NaOH溶液,混合液pH=7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮气可以作食品包装、灯泡等的填充气。一种实验室制备氮气的方法是:NH4Cl+NaNO2=NaCl+2H2O+N2↑ 。反应发生后即停止加热,反应仍可持续进行,直至反应完全。下列说法正确的是
A.该反应只有在低温下才能自发进行
B.NH4Cl的电子式: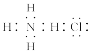
C.元素的电负性:Cl>O>H
D.①和②示意图表示的钠原子,电离出最外层一个电子所需要的能量:①>② ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年诺贝尔化学奖授予在开发锂离子电池方面做出卓越贡献的三位化学家。锂离子电池的广泛应用要求处理电池废料以节约资源、保护环境。采用湿法冶金工艺回收废旧磷酸亚铁锂电池正极片(由Al箔、LiFePO4活性材料、少量不溶于酸碱的导电剂组成)中的资源,部分流程如图:
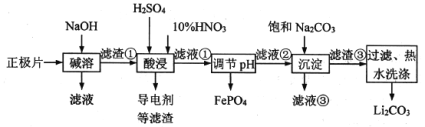
已知:Ksp(Li2CO3)=1.6×10-3。部分物质的溶解度(S)如表所示:
T/℃ | S(Li2CO3)/g | S(Li2SO4)/g | S(Li3PO4)/g | S(LiH2PO4)/g |
20 | 1.33 | 34.2 | 0.039 | 126 |
80 | 0.85 | 30.5 | —— | —— |
(1)将回收的废旧锂离子电池进行预放电、拆分破碎、热处理等预处理,筛分后获得正极片。下列分析你认为合理的是__________。
A.废旧锂离子电池在处理之前需要进行彻底放电,否则在后续处理中,残余的能量会集中释放,可能会造成安全隐患。
B.预放电时电池中的锂离子移向负极,不利于提高正极片中锂元素的回收率。
C.热处理过程可以除去废旧锂离子电池中的难溶有机物、碳粉等。
(2)写出碱溶时主要发生反应的离子方程式:________。
(3)为提高酸浸的浸出率,除粉碎、搅拌、升温外,还可采用的方法有______。(写出一种即可)
(4)酸浸时产生标况下3.36 L NO时,溶解LiFePO4________mol(其他杂质不与HNO3反应)。
(5)若滤液②中c(Li+)=4 mol·L-1,加入等体积的Na2CO3后,沉淀中的Li元素占原Li元素总量的90%,计算滤液③中c(CO32-)=__________mol/L。
(6)流程中用“热水洗涤”的原因是________。
(7)工业上将回收的Li2CO3、FePO4粉碎与足量炭黑混合高温灼烧再生制备LiFePO4,写出反应的化学方程式:_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com