
【题目】已知:①2H2O(g)===2H2(g)+O2(g) ΔH=+483.6 kJ·mol-1 ②H2S(g)===H2(g)+S(g) ΔH=+20.1 kJ·mol-1下列判断正确的是( )
A. 氢气的燃烧热:ΔH=-241.8 kJ·mol-1
B. 相同条件下,充分燃烧1 mol H2(g)与1 mol S(g)的混合物比充分燃烧1 mol H2S(g)放热多20.1 kJ
C. 由①②知,水的热稳定性小于硫化氢
D. ②中若生成固态硫,ΔH将增大
【答案】B
【解析】
A.由2H2O(g)=2H2(g)+O2(g)△H=+483.6kJmol-1,可得:H2(g)+ ![]() O2(g)=H2O(g) △H=-241.8kJmol-1,液态水是稳定氧化物,且氢气的物质的量为1mol,所以-241.8kJmol-1不是氢气的燃烧热,故A错误;B.由H2S(g)=H2(g)+S(g) △H=+20.1kJmol-1可知,1molH2(g)与1molS(g)的混合物的总能量大于1mol H2S(g)的总能量,所以充分燃烧1molH2(g)与1molS(g)的混合物比充分燃烧1mol H2S(g)放热多20.1kJ,故B正确;C.H2(g)+S(g)=H2S(g) △H=-20.1kJmol-1,H2(g)+
O2(g)=H2O(g) △H=-241.8kJmol-1,液态水是稳定氧化物,且氢气的物质的量为1mol,所以-241.8kJmol-1不是氢气的燃烧热,故A错误;B.由H2S(g)=H2(g)+S(g) △H=+20.1kJmol-1可知,1molH2(g)与1molS(g)的混合物的总能量大于1mol H2S(g)的总能量,所以充分燃烧1molH2(g)与1molS(g)的混合物比充分燃烧1mol H2S(g)放热多20.1kJ,故B正确;C.H2(g)+S(g)=H2S(g) △H=-20.1kJmol-1,H2(g)+![]() O2(g)=H2O(g) △H=-241.8kJmol-1,放出的热量越多,说明物质的总能量越低,物质越稳定,因此水比硫化氢稳定,故C错误;D.气体变为固体,需要放出热量,则若反应②中生成固态硫,放出的热量大于20.1kJ,ΔH减小,故D错误;故选B。
O2(g)=H2O(g) △H=-241.8kJmol-1,放出的热量越多,说明物质的总能量越低,物质越稳定,因此水比硫化氢稳定,故C错误;D.气体变为固体,需要放出热量,则若反应②中生成固态硫,放出的热量大于20.1kJ,ΔH减小,故D错误;故选B。


 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】据报道以二氧化碳为原料采用特殊的电极电解强酸性的二氧化碳水溶液可得到多种燃料,其原理下图所示,该装置工作时,下列叙述错误的是
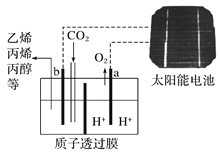
A. b极上生成乙烯的电极反应式为:2CO2+12H++12e-===C2H4+4H2O
B. a接太阳能电池的正极
C. a级上发生还原反应生成标况下22.4 L氧气时,电路中转移的电子数为4NA
D. 溶液中H+通过质子透过膜向b极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某混合物A,含有Al2(SO4)3、Al2O3和Fe2O3,在一定条件下可实现下图所示的变化。

请回答下列问题。
(1)图中涉及分离溶液与沉淀的方法是__________________。
(2)B、C、D、E 4种物质的化学式为:B_________、C_________、D_________、E_________。
(3)沉淀F与NaOH溶液反应的离子方程式为__________________________________。沉淀E与稀硫酸反应的离子方程式为__________________________________________。溶液G与过量稀氨水反应的化学方程式为______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述不正确的是( )
A.除0族元素外,短周期元素的最高正化合价在数值上都等于该元素所属族的族序数
B.除短周期外,其他周期均为18种元素
C.副族元素没有非金属元素
D.第ⅢB族中所含元素种类最多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)许多运动会使用的火炬内熊熊大火来源于丙烷的燃烧,丙烷是一种优良的燃料。试回答下列问题:
①如图是一定量丙烷完全燃烧生成CO2和1 mol H2O过程中的能量变化图,请在图中的括号内填入“+”或“-”。
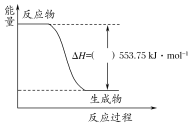
②写出表示丙烷燃烧热的热化学方程式:____________________________________________。
(2)2SO2(g)+O2(g)![]() 2SO3(g)反应过程的能量变化如图所示。已知1 mol SO2(g)氧化为1 mol SO3(g)的ΔH=﹣99 kJmol-1。
2SO3(g)反应过程的能量变化如图所示。已知1 mol SO2(g)氧化为1 mol SO3(g)的ΔH=﹣99 kJmol-1。
请回答下列问题:
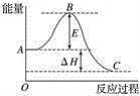
①图中ΔH=______kJmol-1。
②已知单质硫的燃烧热为296 kJmol-1,计算由S(s)生成1 mol SO3(g)的ΔH=______ kJmol-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据报道,磷酸二氢钾(KH2PO4)大晶体已应用于我国研制的巨型激光器“神光二号”中。利用氟磷灰石(化学式为Ca5P3FO12)制备磷酸二氢钾的工艺流程如下图所示(部分流程步骤已省略):
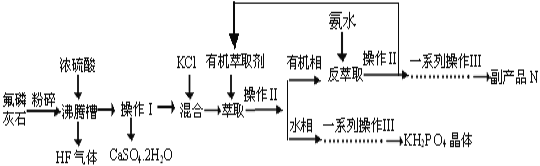
已知萃取的主要反应原理:KCl+H3PO4![]() KH2PO4+HCl;其中,反应产生的HCl易溶于有机萃取剂。
KH2PO4+HCl;其中,反应产生的HCl易溶于有机萃取剂。
请回答下列问题:
(1)流程中将氟磷灰石粉碎的目的是__________________________________。
(2)不能使用二氧化硅陶瓷材质的沸腾槽的主要原因是___________________(用化学方程式表示)。
(3)副产品N的化学式是____________;在得到KH2PO4晶体的一系列操作Ⅲ,其主要包括______________________________、过滤、洗涤、干燥等。
(4)若用1000kg质量分数为50.4%的氟磷灰石(化学式为Ca5P3FO12)来制取磷酸二氢钾晶体,其产率为80%,则理论上可生产KH2PO4的质量为_______kg。
(5)电解法制备KH2PO4的装置如图所示.该电解装置中,a 区属于_______区(填“阳极”或“阴极”),阴极区的电极反应式是______________________________________。

(6)工业上还可以用氟磷灰石与焦炭、石英砂混合,在电炉中加热到1500℃生成白磷,同时逸出SiF4和CO,该反应的化学方程式为________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于化石燃料的说法错误的是( )
A. 石油中含有![]() 的烷烃,可以通过石油的分馏得到汽油
的烷烃,可以通过石油的分馏得到汽油
B. 含![]() 以上烷烃的重油经过催化裂化可以得到汽油
以上烷烃的重油经过催化裂化可以得到汽油
C. 天然气是一种清洁的化石燃料,它作为化工原料,主要用于合成氨和生产甲醇等
D. 煤中含有苯和甲苯,可以用分馏的方法把它们从煤中分离出来
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯是来自石油的重要有机化工原料,其产量通常用来衡量一个国家的石油化工发展水平。结合以下路线回答:

已知:CH3CHO + O2→CH3COOH
(1)上述过程中属于物理变化的是__________(填序号)。
①分馏 ②裂解
(2)A的官能团是__________。
(3)反应II的化学方程式是________________。
(4)D为高分子化合物,可以用来制造多种包装材料,其结构简式是________________。
(5)E是有香味的物质,反应IV的化学方程式是______________________。
(6)下列关于CH2=CH-COOH的说法正确的是__________。
①与CH3CH=CHCOOH互为同系物
②可以与NaHCO3溶液反应放出CO2气体
③在一定条件下可以发生取代、加成、氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A~G为中学化学中常见的物质,B、E、F为单质,在常温下B是一种有色气体,G为黑色固体。它们的相互转化如图所示,部分生成物未列出。试回答下列问题:
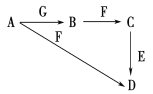
(1)F的一种氧化物常用作红色油漆和涂料,这种氧化物的俗称为________。
(2)E在电气、电子工业中应用最广,也是人类发现最早的金属之一。写出E与C反应的离子方程式________,利用电解法可提纯E物质,在该电解反应中阳极物质是________,阴极物质是________,电解质溶液是__。
(3)写出下列物质的化学式:A________、G________。
(4)将B与SO2等体积混合后,通入品红溶液中,观察到的现象是__________,涉及的离子方程式为______,工业上获得B的重要途径是________(用化学方程式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com