
����Ŀ����ϩ������ʯ�͵���Ҫ�л�����ԭ�ϣ������ͨ����������һ�����ҵ�ʯ�ͻ�����չˮƽ���������·�ش�

��֪��CH3CHO + O2��CH3COOH
��1���������������������仯����__________������ţ���
�ٷ��� ���ѽ�
��2��A��������__________��
��3����ӦII�Ļ�ѧ����ʽ��________________��
��4��DΪ�߷��ӻ������������������ְ�װ���ϣ���ṹ��ʽ��________________��
��5��E������ζ�����ʣ���ӦIV�Ļ�ѧ����ʽ��______________________��
��6�����й���CH2��CH��COOH��˵����ȷ����__________��
����CH3CH��CHCOOH��Ϊͬϵ��
�ڿ�����NaHCO3��Һ��Ӧ�ų�CO2����
����һ�������¿��Է���ȡ�����ӳɡ�������Ӧ
���𰸡��� �ǻ���OH 2CH3CH2OH +O2![]() 2CH3CHO+2H2O
2CH3CHO+2H2O ![]() CH3COOH+CH3CH2OH
CH3COOH+CH3CH2OH![]() CH3COOCH2CH3+H2O �٢ڢ�
CH3COOCH2CH3+H2O �٢ڢ�
��������
��1��ʯ�ͷ���ʱ�����������ʣ��������������仯���ѽ�ʱ���������ʣ��������ڻ�ѧ�仯�����������������������仯���Ǣ٣�
��2����ϩ��ˮ�����ӳɷ�Ӧ�����Ҵ����Ҵ��й��������ǻ���
��3����ͭ���������������������£��Ҵ��ܱ���������������ȩ��ˮ����Ӧ����ʽΪ2CH3CH2OH+O2![]() 2CH3CHO+2H2O��
2CH3CHO+2H2O��
��4����ϩ�����Ӿ۷�Ӧ���ɾ���ϩ����ṹ��ʽΪ![]() ��
��
��5����ϩ��ˮ��Ӧ�����Ҵ����Ҵ��ڴ���������������ȩ����ȩ�����������������ᣬ��Ũ���������������������£��Ҵ������ᷢ��������Ӧ��������������ˮ����ӦIV�Ļ�ѧ����ʽΪ��CH3COOH+CH3CH2OH![]() CH3COOCH2CH3+H2O��
CH3COOCH2CH3+H2O��
��6����CH2=CH-COOH��CH3CH=CHCOOH�ṹ���ƣ����ڷ�����������һ����CH2ԭ���ţ���������ͬϵ���ȷ����CH2=CH-COOH�к����Ȼ����ܺ�̼�����Ʒ�Ӧ���ɶ�����̼����ȷ����CH2=CH-COOH����̼̼˫�����������ں���������ܷ����ӳɷ�Ӧ��ȡ����Ӧ����ȼ�ն�����������Ӧ����ȷ����ѡ�٢ڢۡ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������ʵıȽ��У���ȷ���ǣ� ��
A.�����ԣ�Cl2��Br2B.���ԣ�H2SO4��H3PO4
C.�ȶ��ԣ�HCl��HFD.���ԣ�NaOH��Mg(OH)2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪����2H2O(g)===2H2(g)��O2(g)����H����483.6 kJ��mol��1 ��H2S(g)===H2(g)��S(g)����H����20.1 kJ��mol��1�����ж���ȷ����(����)
A. ������ȼ���ȣ���H����241.8 kJ��mol��1
B. ��ͬ�����£����ȼ��1 mol H2(g)��1 mol S(g)�Ļ����ȳ��ȼ��1 mol H2S(g)���ȶ�20.1 kJ
C. �ɢ٢�֪��ˮ�����ȶ���С������
D. ���������ɹ�̬����H������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(1) �Ҵ������������ϵ����Ӽ�����һ�����������ܱ�����Ϊ��ȩ���Ҵ�����Ϊ��ȩ�ķ�Ӧ����ʽΪ________________���Ҵ�_________��������������������ʹ����KMnO4��Һ��ɫ����֪�����£�2.3 g�Ҵ���һ������������Ϻ��ȼ��ǡ����ȫȼ�գ��ų�68.35 kJ��������÷�Ӧ���Ȼ�ѧ����ʽΪ_______________________��
(2) ��֪��
��ѧ�� | Si��Cl | H��H | H��Cl | Si��Si |
����/kJ��mol��1 | 360 | 436 | 431 | 176 |
�ҹ辧����ÿ����ԭ�Ӻ�����4����ԭ���γ�4�����ۼ�����ҵ����ȡ�ߴ���ķ�Ӧ����ʽΪ��SiCl4(g)��2H2(g)![]() Si(s)��4HCl(g)���÷�Ӧ�ķ�Ӧ��Ϊ________ kJ��mol��1��
Si(s)��4HCl(g)���÷�Ӧ�ķ�Ӧ��Ϊ________ kJ��mol��1��
(3) ��֪ˮ�ı�����Ϊ4.18��10��3 kJ��g-1��oC-1��10 g�����O2����ȫȼ��������̬SO2���ų���������ʹ500 g H2O���¶���18 ������62.4 ��������Ƶ�ȼ����Ϊ_____________���Ȼ�ѧ����ʽΪ__________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������(ά����K)��ֹѪ���ã�����ͨ��2���������������Ƶã���Ӧ�г����������������÷�Ӧ���ȣ��ɱ�ʾΪ��
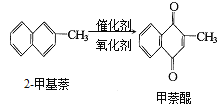
��ij�κϳɷ�Ӧ�У���1��4g��2�����������Ƶ�0��17g����������֪�ôκϳɷ�Ӧ�������ǿ�ģ����жϵ�������ʵ͵�ԭ����
A��ʹ���˹����������� B��û�������ᣬ����ʹ������������
C���ѷ�Ӧ�������� D�������ɵļ������dz�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ֶ���������Ԫ�صIJ�����Ϣ���±���ʾ��
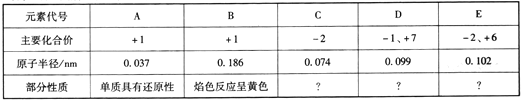
��1��E��Ԫ�����ڱ��е�λ����____________________��
��2����BDC��Һ�еμӷ�̪��Һ����Һ�ȱ�����ɫ��ԭ����__________________(�����ӷ���ʽ��ʾ)��
��3��25��ʱ��pH��Ϊ10��BCA��Һ��B2E��Һ�У�ˮ�������c(OH-)֮��Ϊ____________��
��4��������ʵ�У���˵��D�ķǽ����Ա�Eǿ����________ (����ĸ)��
a��D�ļ��⻯���E���ȶ� b��AD�����Ա�A2E��ǿ
c��D�ĵ��ʵķе����E�ĵ��� d��D2��A2E�ܷ����û���Ӧ
��5��500��ʱ�����ݻ�Ϊ1L�ĺ����ܱ������г���2mol EC3���壬�ڴ��������·�����Ӧ������10minǡ�ôﵽƽ�⣬���ƽ��Ũ��c(C2)=0.75mol��L-1��
�ٷ�Ӧ�ӿ�ʼ��ƽ��ʱ��ƽ����Ӧ����v(EC2)=____________��
��EC3��ƽ��ת����Ϊ____________��
�������������䣬���������г�������EC3���壬��EC3��ƽ��ת���ʻ�________ (�������С�����䡱)��
��6����B2E2C3��Һ�еμ�BAEC4��Һ����������ɫ�������ݳ��̼������壬��Ӧ�����ӷ���ʽΪ____________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�¶��°���ͼ��װ��ʵ��װ�ã�����ƿ��ʢ6.5 gп��(������С������ͬ)��ͨ����Һ©������40 mL 2.5 mol��L��1��������Һ����������H2�ռ���һ��ע�����У���ʱ10 sʱǡ���ռ�����������Ϊ50 mL(���ۺϳ�0 ����101 kPa�����µ�H2���Ϊ44.8 mL)���ڸ��¶��£�����˵������ȷ����(����)

A. ����ͨ���ⶨп�������������ⶨ��Ӧ����
B. ������ƿ����Һ����ı仯����H������ʾ10 s�ڸ÷�Ӧ������Ϊ0.01 mol��L��1��s��1
C. ������ƿ����Һ����ı仯����Zn2������ʾ10 s�ڸ÷�Ӧ����Ϊ0.01 mol��L��1��s��1
D. ��H2����ʾ10 s�ڸ÷�Ӧ������Ϊ0. 000 2 mol��s��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ��mA(g)��nB(g) ![]() pC(g)���ﵽƽ��������¶�ʱ��B��ת���ʱ����Сѹǿʱ�������ϵ��C������������С����
pC(g)���ﵽƽ��������¶�ʱ��B��ת���ʱ����Сѹǿʱ�������ϵ��C������������С����
(1)�÷�Ӧ���淴ӦΪ______(��������������������)��Ӧ����m��n______(����>������������<��)p��
(2)��ѹʹ�����������ʱ��A����������________��(��������������С����������������ͬ)
(3)���ݻ��������B����A��ת����__________��B��ת����________��
(4)�������¶ȣ���ƽ��ʱB��C��Ũ��֮��![]() ��________��
��________��
(5)�����������ƽ��ʱ��������������ʵ���______________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������۲�����װ�ã�����˵���������
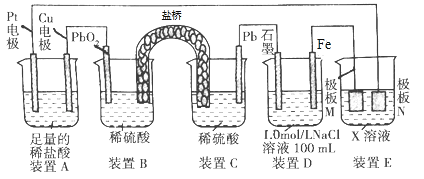
A. װ��B��PbO2�Ϸ����ĵ缫��Ӧ����ʽΪPbO2+4H++SO42-+2e����PbSO4+2H2O
B. װ��A���ܷ�Ӧ�����ӷ���ʽΪCu+2H+![]() Cu2++H2��
Cu2++H2��
C. ����װ��D������0.2 mol Fe(OH)3��������ˮ�����ʵ�����Ϊ0.5 mol
D. ��װ��E��Ŀ������Cu�����϶�������N�IJ���ΪCu
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com