
【题目】认真观察下列装置,下列说法错误的是
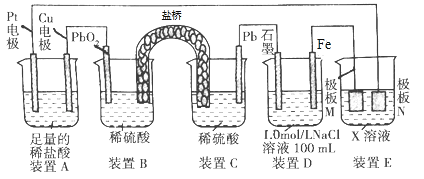
A. 装置B中PbO2上发生的电极反应方程式为PbO2+4H++SO42-+2e-=PbSO4+2H2O
B. 装置A中总反应的离子方程式为Cu+2H+![]() Cu2++H2↑
Cu2++H2↑
C. 若在装置D中生成0.2 mol Fe(OH)3,则消耗水的物质的量共为0.5 mol
D. 若装置E的目的是在Cu材料上镀银,则极板N的材料为Cu
【答案】D
【解析】
B、C装置是含盐桥的原电池装置,其它为串联关系的电解池,结合原电池和电解池的工作原理分析解答。
A.图中B、C装置是含盐桥的原电池装置,PbO2是正极发生还原反应,电极反应式为:PbO2+4H++SO42-+2e-=PbSO4+2H2O,故A正确;
B.铜与原电池的正极相连是阳极,发生氧化反应,所以阳极铜本身放电生成铜离子,阴极是酸电离出的氢离子放电,生成氢气,总的电极反应式为:Cu+2H+![]() Cu2++H2↑,故B正确;
Cu2++H2↑,故B正确;
C.得到0.2mol Fe(OH)3沉淀,涉及反应有Fe+2H2O![]() Fe(OH)2+H2↑,4Fe(OH)2+O2+2H2O=4Fe(OH)3,关系式为4Fe~10H2O,则得到0.2mol Fe(OH)3沉淀消耗0.5mol水,故C正确;
Fe(OH)2+H2↑,4Fe(OH)2+O2+2H2O=4Fe(OH)3,关系式为4Fe~10H2O,则得到0.2mol Fe(OH)3沉淀消耗0.5mol水,故C正确;
D.N是阳极,阳极应是镀层金属银,所以极板M的材料为Cu,故D错误;
答案选D。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】乙烯是来自石油的重要有机化工原料,其产量通常用来衡量一个国家的石油化工发展水平。结合以下路线回答:

已知:CH3CHO + O2→CH3COOH
(1)上述过程中属于物理变化的是__________(填序号)。
①分馏 ②裂解
(2)A的官能团是__________。
(3)反应II的化学方程式是________________。
(4)D为高分子化合物,可以用来制造多种包装材料,其结构简式是________________。
(5)E是有香味的物质,反应IV的化学方程式是______________________。
(6)下列关于CH2=CH-COOH的说法正确的是__________。
①与CH3CH=CHCOOH互为同系物
②可以与NaHCO3溶液反应放出CO2气体
③在一定条件下可以发生取代、加成、氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A~G为中学化学中常见的物质,B、E、F为单质,在常温下B是一种有色气体,G为黑色固体。它们的相互转化如图所示,部分生成物未列出。试回答下列问题:
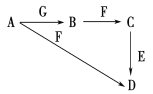
(1)F的一种氧化物常用作红色油漆和涂料,这种氧化物的俗称为________。
(2)E在电气、电子工业中应用最广,也是人类发现最早的金属之一。写出E与C反应的离子方程式________,利用电解法可提纯E物质,在该电解反应中阳极物质是________,阴极物质是________,电解质溶液是__。
(3)写出下列物质的化学式:A________、G________。
(4)将B与SO2等体积混合后,通入品红溶液中,观察到的现象是__________,涉及的离子方程式为______,工业上获得B的重要途径是________(用化学方程式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组用0.50 mol·L-1 NaOH溶液和0.50 mol·L-1 硫酸溶液进行中和热的测定。

(1)测定稀硫酸和稀氢氧化钠中和热的实验装置如图所示,其中仪器a的名称为_____________;
(2)写出该反应中和热的热化学方程式(中和热为57.3 kJ·mol-1)______________;
(3)取50 mL NaOH溶液和30 mL硫酸溶液进行实验,实验数据如下表。
① 请填写下表中的空白:
温度 实验次数 | 起始温度t1/℃ | 终止温度 t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
H2SO4 | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 30.1 | __________ |
2 | 27.0 | 27.4 | 26.2 | 31.2 | |
3 | 25.9 | 25.9 | 25.9 | 29.8 | |
4 | 26.4 | 26.2 | 26.3 | 30.4 | |
② 近似认为0.50 mol·L-1 NaOH溶液和0.50 mol·L-1 硫酸溶液的密度都是1 g·cm-3,中和后生成溶液的比热容c=4.18kJ·(kg·℃)-1。则中和热ΔH=________________________(取小数点后一位);
③ 上述实验数据结果与57.3 kJ·mol-1有偏差, 产生偏差的原因不可能是(填字母)________。
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.某温度时,在容积为2L的密闭容器中,X、Y、Z三种物质的物质的量随时间变化的曲线如图所示,请回答:
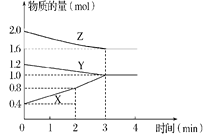
(1)该反应的化学方程式为_________(用X、Y、Z表示)。
(2)从反应开始至2 min末,X的平均反应速率为___________________。
(3)该反应由________(填字母序号)开始的。
A 正反应 B 逆反应 C 正、逆反应同时
(4)其他条件不变,只增加Y的用量,若该反应的速率不发生变化,则Y为___________态。
Ⅱ. 亚硫酸钠和碘酸钾在酸性溶液中反应的化学方程式为 5Na2SO3+2KIO3+H2SO4 = 5Na2SO4+K2SO4+I2+H2O,该反应的机理较复杂,一般认为分以下几步:
①IO3- + SO32-→ IO2- + SO42-(慢); ②IO2- + SO32-→ IO- + SO42-(快);
③5I-+ 6H+ + IO3- →3I2 +3H2O(快); ④I2 + SO32- + H2O →2I- +SO42- + 2H+(快)。
(1)据此推测,该反应的总反应速率由__________步反应决定。
(2)若预先在酸性溶液中加入淀粉溶液,当_________离子(填对应离子符号)反应完时溶液才会变蓝。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】球墨铸铁中含有一种铁碳化合物X。实验小组为测定化合物X的组成设计实验如下:
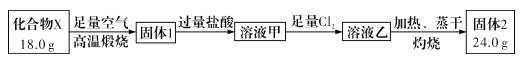
下列说法不正确的是
A. 固体2是氧化铁
B. X的化学式可以表示为Fe3C2
C. 将溶液甲在空气中加热、蒸干、灼烧也可得到24.0g固体
D. X与足量的热浓硝酸反应有NO2和CO2生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜的冶炼大致可分为以下几个步骤:
(1)富集,将硫化物矿进行浮选;
(2)焙烧,主要反应为![]()
![]()
![]() (炉渣);
(炉渣);
(3)制粗铜,在1200℃的条件下发生的主要反应为![]()
![]()
![]() ,
,![]()
![]()
![]() ;
;
(4)电解精炼。
下列说法不正确的是
A. 上述焙烧过程中的尾气不可直接排放
B. 由6mol![]() 生成6molCu时,在整个过程中共消耗15mol
生成6molCu时,在整个过程中共消耗15mol![]()
C. 在反应中![]()
![]()
![]() ,只有
,只有![]() 作氧化剂
作氧化剂
D. 电解精炼属于化学变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】双氧水、84消毒液是日常生活中常用的消毒剂。
(1)84消毒液(主要成分是NaClO)溶液呈碱性,用离子方程式表示其原因:_____________________。
(2)双氧水和84消毒液混合失去消毒作用,并产生无色无味气体,在该反应中氧化剂是____________。
(3)工业上,制备84消毒液的原理是:以惰性电极电解饱和氯化钠溶液,产生的氯气用生成的烧碱溶液吸收。阴极发生的电极反应式为_________________________;写出总反应的化学方程式______________。
(4)实验室分别用KMnO4、H2O2、KClO3制备O2,当得到等质量的O2时,各反应中转移电子的数目之比为______________。
(5)双氧水是二元弱酸,298 K时,Ka1=1.6×1012,Ka2=1.0×1025。则298 K时,0.1 mol·L1双氧水溶液的pH≈________________。(已知:lg2≈0.3)
(6)将V2O5溶于足量稀硫酸得到250mL(VO2)2SO4溶液。取25.00mL该溶液于锥形瓶中,用0.1000 mol·L-1H2C2O4标准溶液进行滴定,达到滴定终点时消耗标准溶液的体积为20.00mL。已知滴定过程中H2C2O4被氧化为CO2,VO2+(黄色)被还原为VO2+(蓝色)。
①该滴定实验不需要另外加入指示剂,达到滴定终点的现象是___________________。
②(VO2)2SO4溶液中溶质的物质的量浓度为___________________。
③达到滴定终点时,仰视滴定管读数将使结果_________(填“偏高”、“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应A(g)+3B(g) ![]() 2C(g)+D(g) 在四种不同情况下的反应速率如下,其中反应进行得最快的是( )
2C(g)+D(g) 在四种不同情况下的反应速率如下,其中反应进行得最快的是( )
A.VA=0.15mol(Lmin)﹣1 B.VB=0.6 mol(Lmin)﹣1
C.VC=0.4 mol(Lmin)﹣1 D.VD=0.01 mol(Ls)﹣1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com