
【题目】某实验小组用0.50 mol·L-1 NaOH溶液和0.50 mol·L-1 硫酸溶液进行中和热的测定。

(1)测定稀硫酸和稀氢氧化钠中和热的实验装置如图所示,其中仪器a的名称为_____________;
(2)写出该反应中和热的热化学方程式(中和热为57.3 kJ·mol-1)______________;
(3)取50 mL NaOH溶液和30 mL硫酸溶液进行实验,实验数据如下表。
① 请填写下表中的空白:
温度 实验次数 | 起始温度t1/℃ | 终止温度 t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
H2SO4 | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 30.1 | __________ |
2 | 27.0 | 27.4 | 26.2 | 31.2 | |
3 | 25.9 | 25.9 | 25.9 | 29.8 | |
4 | 26.4 | 26.2 | 26.3 | 30.4 | |
② 近似认为0.50 mol·L-1 NaOH溶液和0.50 mol·L-1 硫酸溶液的密度都是1 g·cm-3,中和后生成溶液的比热容c=4.18kJ·(kg·℃)-1。则中和热ΔH=________________________(取小数点后一位);
③ 上述实验数据结果与57.3 kJ·mol-1有偏差, 产生偏差的原因不可能是(填字母)________。
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
【答案】环形玻璃搅拌棒1/2H2SO4(aq)+NaOH(aq)== 1/2Na2SO4(aq)+H2O(l) ΔH=-57.3kJ·mol-14.0-53.5 kJ·mol-1b
【解析】
(1) 如图,根据测定中和热的实验装置可知,仪器a为环形玻璃搅拌棒;因此本题答案是:环形玻璃搅拌棒。
(2) 稀强酸、稀强碱反应生成1mol液态水时放出57.3 kJ 的热量,稀硫酸和稀氢氧化钠反应的中和热的热化学方程式: 1/2H2SO4(aq)+NaOH(aq)== 1/2Na2SO4(aq)+H2O(l) ΔH=-57.3kJ·mol-1;综上所述,本题答案是:1/2H2SO4(aq)+NaOH(aq)== 1/2Na2SO4(aq)+H2O(l) ΔH=-57.3kJ·mol-1。
(3) ①4次温度差分别为:4.0℃,5.0℃,3.9℃,4.1℃,5.0℃误差太大,舍去,其余三组有效,温度差平均值4.0℃,因此本题答案是:4.0。
②50mL0.50 mol·L-1 NaOH氢氧化钠与30mL0.50 mol·L-1 H2SO4硫酸溶液进行中和反应,生成水的物质的量为0.05×0.50=0.025mol,溶液的质量为80×1=80g,温度变化的值为T=4.0℃,则生成0.025mol水放出的热量Q=m×c×T=80×4.18×4.0=1337.6J=1.3376kJ,所以实验测得的中和热ΔH=-1.3376/0.025=-53.5 kJ·mol-1;综上所述,本题答案是:-53.5 kJ·mol-1。
③保温效果不好,测得的热量偏小,中和热数值偏小,a有可能;量取NaOH溶液时,仰视NaOH溶液的体积增多,放出的热量偏高,中和热数值偏大,b不可能;分多次加入NaOH溶液也会使热量散失,测得的热量偏小,中和热数值偏小,c有可能;d项提前中和了一部分酸和碱,硫酸的起始温度偏高,测得的热量偏小,中和热数值偏小,d有可能;综上所述,本题选b。


科目:高中化学 来源: 题型:
【题目】(1) 乙醇常被用做饮料的添加剂,在一定的条件下能被氧化为乙醛,乙醇氧化为乙醛的反应方程式为________________;乙醇_________(“能”或“不能”)使酸性KMnO4溶液褪色;已知常温下,2.3 g乙醇和一定量的氧气混合后点燃,恰好完全燃烧,放出68.35 kJ热量,则该反应的热化学方程式为_______________________。
(2) 已知:
化学键 | Si—Cl | H—H | H—Cl | Si—Si |
键能/kJ·mol-1 | 360 | 436 | 431 | 176 |
且硅晶体中每个硅原子和其他4个硅原子形成4个共价键,工业上制取高纯硅的反应方程式为:SiCl4(g)+2H2(g)![]() Si(s)+4HCl(g),该反应的反应热为________ kJ·mol-1。
Si(s)+4HCl(g),该反应的反应热为________ kJ·mol-1。
(3) 已知水的比热容为4.18×10-3 kJ·g-1·oC-1。10 g硫黄在O2中完全燃烧生成气态SO2,放出的热量能使500 g H2O的温度由18 ℃升至62.4 ℃,则硫黄的燃烧热为_____________,热化学方程式为__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有反应:mA(g)+nB(g) ![]() pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数减小,则:
pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数减小,则:
(1)该反应的逆反应为______(填“吸热”或“放热”)反应,且m+n______(填“>”“=”或“<”)p。
(2)减压使容器体积增大时,A的质量分数________。(填“增大”“减小”或“不变”,下同)
(3)若容积不变加入B,则A的转化率__________,B的转化率________。
(4)若升高温度,则平衡时B、C的浓度之比![]() 将________。
将________。
(5)若加入催化剂,平衡时气体混合物的总物质的量______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】银锌纽扣电池,其电池的电池反应式为Zn+ Ag2O+H2O =Zn(OH)2+2Ag。据此判断氧化银是 ( )
A.负极,并被氧化B.正极,并被还原
C.负极,并被还原D.正极,并被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中不正确的是
A. 可逆反应设计成双液电池,当反应达平衡时,外电路上没有电流通过
B. 将 NO2、N2O4 平衡混合气体的体积压缩为原来的一半,新平衡后气体颜色加深
C. 利用盖斯定律,可以计算某些难以直接测量的反应焓变
D. 抗腐蚀的金属一定排在金属活动性顺序表氢元素之后
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A. 15g甲基(-CH3)中含有的电子数为9NA
B. 标准状况下,2.24L己烷中所含碳原子数为0.6NA
C. 0.1mol Fe与足量稀硫酸反应时,转移电子数为0.3NA
D. 由2SO2+O2![]() 2SO3可知,2mol SO2与1mol O2充分反应生成SO3分子数为2NA
2SO3可知,2mol SO2与1mol O2充分反应生成SO3分子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】认真观察下列装置,下列说法错误的是
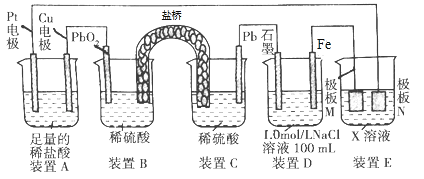
A. 装置B中PbO2上发生的电极反应方程式为PbO2+4H++SO42-+2e-=PbSO4+2H2O
B. 装置A中总反应的离子方程式为Cu+2H+![]() Cu2++H2↑
Cu2++H2↑
C. 若在装置D中生成0.2 mol Fe(OH)3,则消耗水的物质的量共为0.5 mol
D. 若装置E的目的是在Cu材料上镀银,则极板N的材料为Cu
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分类是学习和研究化学的重要方法,下列物质的分类合理的是( )
A.苛性钠、熟石灰、纯碱均属于碱
B.CO2、SO2、SO3均属于酸性氧化物
C.次氯酸、氢硫酸、磷酸均属于含氧酸
D.NH4Cl、NH4NO3、CO(NH2)2均属于铵盐
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯甲酸乙酯(C9H10O2)别名为安息香酸乙酯。它是一种无色透明液体,不溶于水,稍有水果气味,用于配制香水香精和人造精油,大量用于食品工业中,也可用作有机合成中间体,溶剂等。其制备方法为:
已知:
名称 | 相对分子质量 | 颜色,状态 | 沸点(℃) | 密度(g·cm-3) |
苯甲酸 | 122 | 无色片状晶体 | 249 | 1.2659 |
苯甲酸乙酯 | 150 | 无色澄清液体 | 212.6 | 1.05 |
乙醇 | 46 | 无色澄清液体 | 78.3 | 0.7893 |
环己烷 | 84 | 无色澄清液体 | 80.8 | 0.7318 |
苯甲酸在100℃会迅速升华。
实验步骤如下:
①在圆底烧瓶中加入12.20 g苯甲酸,25 mL 95%的乙醇(过量),20 mL环己烷以及4 mL浓硫酸,混合均匀并加入沸石,按下图所示装好仪器,控制温度在65~70℃加热回流2 h。利用分水器不断分离除去反应生成的水,回流环己烷和乙醇。
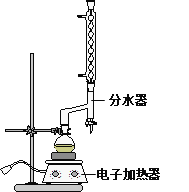
②反应结束,打开旋塞放出分水器中液体后,关闭旋塞,继续加热,至分水器中收集到的液体不再明显增加,停止加热。
③将烧瓶内反应液倒入盛有适量水的烧杯中,分批加入Na2CO3至溶液至呈中性。用分液漏斗分出有机层,水层用25 mL乙醚萃取分液,然后合并至有机层,加入氯化钙,静置,过滤,对滤液进行蒸馏,低温蒸出乙醚和环己烷后,继续升温,接收210~213℃的馏分。
④检验合格,测得产品体积为12.86 mL。
回答下列问题:
(1)在该实验中,圆底烧瓶的容积最适合的是_________(填入正确选项前的字母)。
A.25 mL B.50 mL C.100 mL D.250 mL
(2)步骤①中使用分水器不断分离除去水的目的是_____________________。
(3)步骤②中应控制馏分的温度在____________。
A.65~70℃ B.78~80℃ C.85~90℃ D.215~220℃
(4)步骤③加入Na2CO3的作用是______________________;若Na2CO3加入不足,在之后蒸馏时,蒸馏烧瓶中可见到白烟生成,产生该现象的原因是____________。
(5)关于步骤③中的萃取分液操作叙述正确的是__________。
A.水溶液中加入乙醚,转移至分液漏斗中,塞上玻璃塞,分液漏斗倒转过来,用力振摇
B.振摇几次后需打开分液漏斗上口的玻璃塞放气
C.经几次振摇并放气后,手持分液漏斗静置待液体分层
D.放出液体时,应打开上口玻璃塞或将玻璃塞上的凹槽对准漏斗口上的小孔
(6)计算本实验的产率为_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com