
【题目】分类是学习和研究化学的重要方法,下列物质的分类合理的是( )
A.苛性钠、熟石灰、纯碱均属于碱
B.CO2、SO2、SO3均属于酸性氧化物
C.次氯酸、氢硫酸、磷酸均属于含氧酸
D.NH4Cl、NH4NO3、CO(NH2)2均属于铵盐
科目:高中化学 来源: 题型:
【题目】利用I2O5可消除CO污染,反应为I2O5(s)+5CO(g)![]() 5CO2(g)+I2(s)。不同温度下,向装有足量的I2O5固体的2L恒容密闭容器中通入2mol CO,测得CO2 的体积分数ψ(CO2)随时间t变化曲线如右图,下列说法正确的是
5CO2(g)+I2(s)。不同温度下,向装有足量的I2O5固体的2L恒容密闭容器中通入2mol CO,测得CO2 的体积分数ψ(CO2)随时间t变化曲线如右图,下列说法正确的是

A. b点时,CO的转化率为20%
B. 容器内的压强保持恒定,表明反应达到平衡状态
C. b点和d点的化学平衡常数:Kb>Kd
D. 0到0.5min反应速率v(CO)=0.3mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组用0.50 mol·L-1 NaOH溶液和0.50 mol·L-1 硫酸溶液进行中和热的测定。

(1)测定稀硫酸和稀氢氧化钠中和热的实验装置如图所示,其中仪器a的名称为_____________;
(2)写出该反应中和热的热化学方程式(中和热为57.3 kJ·mol-1)______________;
(3)取50 mL NaOH溶液和30 mL硫酸溶液进行实验,实验数据如下表。
① 请填写下表中的空白:
温度 实验次数 | 起始温度t1/℃ | 终止温度 t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
H2SO4 | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 30.1 | __________ |
2 | 27.0 | 27.4 | 26.2 | 31.2 | |
3 | 25.9 | 25.9 | 25.9 | 29.8 | |
4 | 26.4 | 26.2 | 26.3 | 30.4 | |
② 近似认为0.50 mol·L-1 NaOH溶液和0.50 mol·L-1 硫酸溶液的密度都是1 g·cm-3,中和后生成溶液的比热容c=4.18kJ·(kg·℃)-1。则中和热ΔH=________________________(取小数点后一位);
③ 上述实验数据结果与57.3 kJ·mol-1有偏差, 产生偏差的原因不可能是(填字母)________。
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】球墨铸铁中含有一种铁碳化合物X。实验小组为测定化合物X的组成设计实验如下:
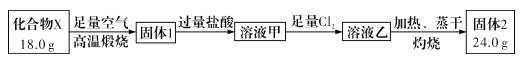
下列说法不正确的是
A. 固体2是氧化铁
B. X的化学式可以表示为Fe3C2
C. 将溶液甲在空气中加热、蒸干、灼烧也可得到24.0g固体
D. X与足量的热浓硝酸反应有NO2和CO2生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜的冶炼大致可分为以下几个步骤:
(1)富集,将硫化物矿进行浮选;
(2)焙烧,主要反应为![]()
![]()
![]() (炉渣);
(炉渣);
(3)制粗铜,在1200℃的条件下发生的主要反应为![]()
![]()
![]() ,
,![]()
![]()
![]() ;
;
(4)电解精炼。
下列说法不正确的是
A. 上述焙烧过程中的尾气不可直接排放
B. 由6mol![]() 生成6molCu时,在整个过程中共消耗15mol
生成6molCu时,在整个过程中共消耗15mol![]()
C. 在反应中![]()
![]()
![]() ,只有
,只有![]() 作氧化剂
作氧化剂
D. 电解精炼属于化学变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验中没有用到玻璃棒的是( )
A.配制100mL0.2molL-1NaOH溶液
B.食盐的精制
C.浓硫酸的稀释
D.Fe(OH)3胶体的制备
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】双氧水、84消毒液是日常生活中常用的消毒剂。
(1)84消毒液(主要成分是NaClO)溶液呈碱性,用离子方程式表示其原因:_____________________。
(2)双氧水和84消毒液混合失去消毒作用,并产生无色无味气体,在该反应中氧化剂是____________。
(3)工业上,制备84消毒液的原理是:以惰性电极电解饱和氯化钠溶液,产生的氯气用生成的烧碱溶液吸收。阴极发生的电极反应式为_________________________;写出总反应的化学方程式______________。
(4)实验室分别用KMnO4、H2O2、KClO3制备O2,当得到等质量的O2时,各反应中转移电子的数目之比为______________。
(5)双氧水是二元弱酸,298 K时,Ka1=1.6×1012,Ka2=1.0×1025。则298 K时,0.1 mol·L1双氧水溶液的pH≈________________。(已知:lg2≈0.3)
(6)将V2O5溶于足量稀硫酸得到250mL(VO2)2SO4溶液。取25.00mL该溶液于锥形瓶中,用0.1000 mol·L-1H2C2O4标准溶液进行滴定,达到滴定终点时消耗标准溶液的体积为20.00mL。已知滴定过程中H2C2O4被氧化为CO2,VO2+(黄色)被还原为VO2+(蓝色)。
①该滴定实验不需要另外加入指示剂,达到滴定终点的现象是___________________。
②(VO2)2SO4溶液中溶质的物质的量浓度为___________________。
③达到滴定终点时,仰视滴定管读数将使结果_________(填“偏高”、“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学利用氧化还原反应:2KMnO4+10FeSO4+8H2SO4=2MnSO4+5Fe2(SO4)3+K2SO4 +8H2O设计如下原电池,盐桥中装有饱和KCl溶液。下列说法正确的是
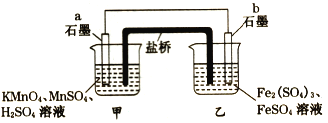
A. b电极上发生还原反应
B. 外电路电子的流向是从a到b
C. 电池工作时,盐桥中的SO42-移向甲烧杯
D. a电极上发生的反应为:MnO4-+8H++5e- = Mn2++4H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中进行反应2SO2+O2![]() 2SO3,反应达平衡的标志是
2SO3,反应达平衡的标志是
①单位时间内消耗2 mol SO2的同时生成2 mol SO3
②反应混合物中,SO2、O2与SO3的物质的量之比为2∶1∶2
③反应混合物中,SO3的质量分数不再改变
A. ①②B. ①③C. ①D. ③
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com