
【题目】铜的冶炼大致可分为以下几个步骤:
(1)富集,将硫化物矿进行浮选;
(2)焙烧,主要反应为![]()
![]()
![]() (炉渣);
(炉渣);
(3)制粗铜,在1200℃的条件下发生的主要反应为![]()
![]()
![]() ,
,![]()
![]()
![]() ;
;
(4)电解精炼。
下列说法不正确的是
A. 上述焙烧过程中的尾气不可直接排放
B. 由6mol![]() 生成6molCu时,在整个过程中共消耗15mol
生成6molCu时,在整个过程中共消耗15mol![]()
C. 在反应中![]()
![]()
![]() ,只有
,只有![]() 作氧化剂
作氧化剂
D. 电解精炼属于化学变化
 小学教材全测系列答案
小学教材全测系列答案科目:高中化学 来源: 题型:
【题目】某温度下按如图安装好实验装置,在锥形瓶内盛6.5 g锌粒(颗粒大小基本相同),通过分液漏斗加入40 mL 2.5 mol·L-1的硫酸溶液,将产生的H2收集在一个注射器中,用时10 s时恰好收集到气体的体积为50 mL(若折合成0 ℃、101 kPa条件下的H2体积为44.8 mL),在该温度下,下列说法不正确的是( )

A. 可以通过测定锌粒减少质量来测定反应速率
B. 忽略锥形瓶内溶液体积的变化,用H+来表示10 s内该反应的速率为0.01 mol·L-1·s-1
C. 忽略锥形瓶内溶液体积的变化,用Zn2+来表示10 s内该反应速率为0.01 mol·L-1·s-1
D. 用H2来表示10 s内该反应的速率为0. 000 2 mol·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中不正确的是
A. 可逆反应设计成双液电池,当反应达平衡时,外电路上没有电流通过
B. 将 NO2、N2O4 平衡混合气体的体积压缩为原来的一半,新平衡后气体颜色加深
C. 利用盖斯定律,可以计算某些难以直接测量的反应焓变
D. 抗腐蚀的金属一定排在金属活动性顺序表氢元素之后
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】认真观察下列装置,下列说法错误的是
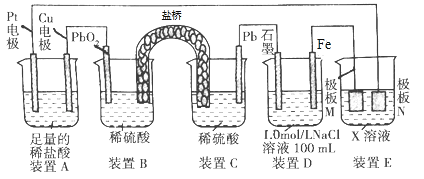
A. 装置B中PbO2上发生的电极反应方程式为PbO2+4H++SO42-+2e-=PbSO4+2H2O
B. 装置A中总反应的离子方程式为Cu+2H+![]() Cu2++H2↑
Cu2++H2↑
C. 若在装置D中生成0.2 mol Fe(OH)3,则消耗水的物质的量共为0.5 mol
D. 若装置E的目的是在Cu材料上镀银,则极板N的材料为Cu
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向20 mL 0.5 mol·L-1的醋酸溶液中逐滴加入等物质的量浓度的烧碱溶液,测定混合溶液的温度变化如图所示。下列关于混合溶液的相关说法中错误的是

A. 醋酸的电离平衡常数:B点>A点
B. 由水电离出的c(OH-):B点>C点
C. 从A点到B点,混合溶液中可能存在:c(CH3COO-)=c(Na+)
D. 从B点到C点,混合溶液中一直存在:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分类是学习和研究化学的重要方法,下列物质的分类合理的是( )
A.苛性钠、熟石灰、纯碱均属于碱
B.CO2、SO2、SO3均属于酸性氧化物
C.次氯酸、氢硫酸、磷酸均属于含氧酸
D.NH4Cl、NH4NO3、CO(NH2)2均属于铵盐
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家设计出质子膜H2S燃料电池,实现了利用H2S废气资源回收能量并得到单质硫。质子膜H2S燃料电池的结构示意图如图所示。下列说法不正确的是( )
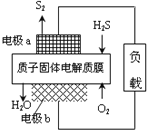
A. 电极a为电池的负极
B. 电极b上发生的电极反应为:O2+4H++4e-═2H2O
C. 电路中每流过2mol电子,在正极消耗22.4L H2S
D. 每34g H2S参与反应,有2mol H+经质子膜进入正极区
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钢铁行业是工业生产的重要支柱。
(1)已知高炉炼铁的主要反应为:
①Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) △H=-25 kJ·mol-1
②3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g) △H=-47 kJ·mol-1
③Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) △H=+19 kJ·mol-1
写出FeO(s)被CO还原生成Fe(s)和CO2的热化学方程式:________________。
(2)恒温恒容条件下进行反应Fe2O3(s)+3CO(g)![]() 2Fe(s)+3CO2(g),下列各项能说明该反应已达到平衡状态的是_______(填写序号字母)。
2Fe(s)+3CO2(g),下列各项能说明该反应已达到平衡状态的是_______(填写序号字母)。
a.v(CO)正=v(CO2)逆 b.CO、CO2 的浓度之比为1:1
c.容器内压强保持不变 d.混合气体的密度保持不变
(3)ToC时,反应Fe2O3(s)+3CO(g)![]() 2Fe(s)+3CO2(g)的平衡常数为K=27。在1L的密闭容器中分别按下表所示加入物质,维持ToC反应一段时间达到平衡,甲、乙容器中CO的平衡转化率之比=_________。
2Fe(s)+3CO2(g)的平衡常数为K=27。在1L的密闭容器中分别按下表所示加入物质,维持ToC反应一段时间达到平衡,甲、乙容器中CO的平衡转化率之比=_________。
Fe2O3 | CO | Fe | CO2 | |
甲容器 | 1.0 mol | 1.0 mol | 1.0 mol | 1.0 mol |
乙容器 | 1.0 mol | 2.0 mol | 1.0 mol | 1.0 mol |
(4)下列为合成甲醇的有关化学方程式:
①2H2(g)+CO(g) ![]() CH3OH(g)
CH3OH(g)
②H2(g)+CO2(g) ![]() H2O(g)+CO(g)
H2O(g)+CO(g)
③3H2(g)+CO2(g) ![]() CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
某温度下,上述三个反应的平衡常数数值分别为2.5,2.0和K3,则K3值为_______。
(5)比亚迪双模电动汽车使用高铁电池供电。高铁电池的总反应为:3Zn(OH)2+2Fe(OH)3+4KOH![]() 3Zn+2K2FeO4+8H2O,则充电时的阳极反应式为__________。
3Zn+2K2FeO4+8H2O,则充电时的阳极反应式为__________。
(6)炼铁尾气中含有CO,经过回收可用于合成甲醇:2H2(g)+CO(g)![]() CH3OH(g) △H=-90.1 kJ·mol-1。ToC,该反应的Kp=6.0×10-3kPa-2(用平衡分压代替平衡浓度所得平衡常数,分压= 总压×物质的量分数)。该温度下的某容器中,若起始充入2molH2、1molCO,平衡时甲醇的平衡分压p(CH3OH)=24.0kPa,则平衡时混合气体中CH3OH的体积分数约为________(用百分数表示,小数点后保留1位)。
CH3OH(g) △H=-90.1 kJ·mol-1。ToC,该反应的Kp=6.0×10-3kPa-2(用平衡分压代替平衡浓度所得平衡常数,分压= 总压×物质的量分数)。该温度下的某容器中,若起始充入2molH2、1molCO,平衡时甲醇的平衡分压p(CH3OH)=24.0kPa,则平衡时混合气体中CH3OH的体积分数约为________(用百分数表示,小数点后保留1位)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com