
【题目】下列叙述中不正确的是
A. 可逆反应设计成双液电池,当反应达平衡时,外电路上没有电流通过
B. 将 NO2、N2O4 平衡混合气体的体积压缩为原来的一半,新平衡后气体颜色加深
C. 利用盖斯定律,可以计算某些难以直接测量的反应焓变
D. 抗腐蚀的金属一定排在金属活动性顺序表氢元素之后
 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案科目:高中化学 来源: 题型:
【题目】下列关于化石燃料的说法错误的是( )
A. 石油中含有![]() 的烷烃,可以通过石油的分馏得到汽油
的烷烃,可以通过石油的分馏得到汽油
B. 含![]() 以上烷烃的重油经过催化裂化可以得到汽油
以上烷烃的重油经过催化裂化可以得到汽油
C. 天然气是一种清洁的化石燃料,它作为化工原料,主要用于合成氨和生产甲醇等
D. 煤中含有苯和甲苯,可以用分馏的方法把它们从煤中分离出来
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将氯气通入70℃的氢氧化钠水溶液中,能同时发生两个自身氧化还原反应(未配平):NaOH+Cl2→NaCl+NaClO+H2O,反应完成后测得溶液中NaClO与NaClO3的数目之比为5:2,则该溶液中NaCl与NaClO的数目之比为( )
A.3:1B.2:1C.15:2D.1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A~G为中学化学中常见的物质,B、E、F为单质,在常温下B是一种有色气体,G为黑色固体。它们的相互转化如图所示,部分生成物未列出。试回答下列问题:
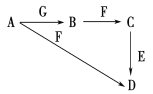
(1)F的一种氧化物常用作红色油漆和涂料,这种氧化物的俗称为________。
(2)E在电气、电子工业中应用最广,也是人类发现最早的金属之一。写出E与C反应的离子方程式________,利用电解法可提纯E物质,在该电解反应中阳极物质是________,阴极物质是________,电解质溶液是__。
(3)写出下列物质的化学式:A________、G________。
(4)将B与SO2等体积混合后,通入品红溶液中,观察到的现象是__________,涉及的离子方程式为______,工业上获得B的重要途径是________(用化学方程式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将4 mol A气体和2 mol B气体充入2 L的密闭容器中,一定条件下发生如下反应:2A(g)+B(g)![]() 2C(g)。若经2 s后测得C的浓度为0.6 mol/L,下列几种说法正确的是
2C(g)。若经2 s后测得C的浓度为0.6 mol/L,下列几种说法正确的是
①用物质A表示的反应平均速率为0.3 mol/(L·s)
②用物质B表示的反应的平均速率为0.6 mol/(L·s)
③2 s时物质A的转化率为70%
④2 s时物质B的浓度为0.7 mol/L
A. ①③ B. ①④ C. ②③ D. ③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组用0.50 mol·L-1 NaOH溶液和0.50 mol·L-1 硫酸溶液进行中和热的测定。

(1)测定稀硫酸和稀氢氧化钠中和热的实验装置如图所示,其中仪器a的名称为_____________;
(2)写出该反应中和热的热化学方程式(中和热为57.3 kJ·mol-1)______________;
(3)取50 mL NaOH溶液和30 mL硫酸溶液进行实验,实验数据如下表。
① 请填写下表中的空白:
温度 实验次数 | 起始温度t1/℃ | 终止温度 t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
H2SO4 | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 30.1 | __________ |
2 | 27.0 | 27.4 | 26.2 | 31.2 | |
3 | 25.9 | 25.9 | 25.9 | 29.8 | |
4 | 26.4 | 26.2 | 26.3 | 30.4 | |
② 近似认为0.50 mol·L-1 NaOH溶液和0.50 mol·L-1 硫酸溶液的密度都是1 g·cm-3,中和后生成溶液的比热容c=4.18kJ·(kg·℃)-1。则中和热ΔH=________________________(取小数点后一位);
③ 上述实验数据结果与57.3 kJ·mol-1有偏差, 产生偏差的原因不可能是(填字母)________。
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.某温度时,在容积为2L的密闭容器中,X、Y、Z三种物质的物质的量随时间变化的曲线如图所示,请回答:
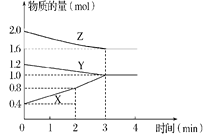
(1)该反应的化学方程式为_________(用X、Y、Z表示)。
(2)从反应开始至2 min末,X的平均反应速率为___________________。
(3)该反应由________(填字母序号)开始的。
A 正反应 B 逆反应 C 正、逆反应同时
(4)其他条件不变,只增加Y的用量,若该反应的速率不发生变化,则Y为___________态。
Ⅱ. 亚硫酸钠和碘酸钾在酸性溶液中反应的化学方程式为 5Na2SO3+2KIO3+H2SO4 = 5Na2SO4+K2SO4+I2+H2O,该反应的机理较复杂,一般认为分以下几步:
①IO3- + SO32-→ IO2- + SO42-(慢); ②IO2- + SO32-→ IO- + SO42-(快);
③5I-+ 6H+ + IO3- →3I2 +3H2O(快); ④I2 + SO32- + H2O →2I- +SO42- + 2H+(快)。
(1)据此推测,该反应的总反应速率由__________步反应决定。
(2)若预先在酸性溶液中加入淀粉溶液,当_________离子(填对应离子符号)反应完时溶液才会变蓝。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜的冶炼大致可分为以下几个步骤:
(1)富集,将硫化物矿进行浮选;
(2)焙烧,主要反应为![]()
![]()
![]() (炉渣);
(炉渣);
(3)制粗铜,在1200℃的条件下发生的主要反应为![]()
![]()
![]() ,
,![]()
![]()
![]() ;
;
(4)电解精炼。
下列说法不正确的是
A. 上述焙烧过程中的尾气不可直接排放
B. 由6mol![]() 生成6molCu时,在整个过程中共消耗15mol
生成6molCu时,在整个过程中共消耗15mol![]()
C. 在反应中![]()
![]()
![]() ,只有
,只有![]() 作氧化剂
作氧化剂
D. 电解精炼属于化学变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.实验室应将钠保存在煤油中B.清洗完的分液漏斗和容量瓶都要干燥
C.可用酒精代替CCl4萃取碘水中的碘单质D.二氧化碳是酸雨的主要成分
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com