
【题目】将氯气通入70℃的氢氧化钠水溶液中,能同时发生两个自身氧化还原反应(未配平):NaOH+Cl2→NaCl+NaClO+H2O,反应完成后测得溶液中NaClO与NaClO3的数目之比为5:2,则该溶液中NaCl与NaClO的数目之比为( )
A.3:1B.2:1C.15:2D.1:1
科目:高中化学 来源: 题型:
【题目】下列关于甲烷、乙烯、苯三种烃的比较中,正确的是![]()
![]()
A. 只有甲烷不能因化学反应而使酸性高锰酸钾溶液褪色
B. 除甲烷外,其余两种分子内所有原子都共平面
C. 甲烷和苯属于饱和烃,乙烯是不饱和烃
D. 在空气中分别完全燃烧等质量的这三种烃,苯消耗的氧气最多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲萘醌(维生素K)有止血作用,它可通过2—甲基萘的氧化而制得,反应中常用乙酸作催化剂,该反应放热,可表示为:
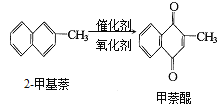
在某次合成反应中,用1.4g的2—甲基萘,才制得0.17g甲萘醌,已知该次合成反应的速率是快的,试判断导致其产率低的原因是
A.使用了过量的氧化剂 B.没有用乙酸,而是使用了其它催化剂
C.把反应混合物加热 D.所生成的甲萘醌是沉淀物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下按如图安装好实验装置,在锥形瓶内盛6.5 g锌粒(颗粒大小基本相同),通过分液漏斗加入40 mL 2.5 mol·L-1的硫酸溶液,将产生的H2收集在一个注射器中,用时10 s时恰好收集到气体的体积为50 mL(若折合成0 ℃、101 kPa条件下的H2体积为44.8 mL),在该温度下,下列说法不正确的是( )

A. 可以通过测定锌粒减少质量来测定反应速率
B. 忽略锥形瓶内溶液体积的变化,用H+来表示10 s内该反应的速率为0.01 mol·L-1·s-1
C. 忽略锥形瓶内溶液体积的变化,用Zn2+来表示10 s内该反应速率为0.01 mol·L-1·s-1
D. 用H2来表示10 s内该反应的速率为0. 000 2 mol·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在100℃时,将0.100mol的四氧化二氮气体充入1L 抽空的密闭容器中,隔一定时间对该容器内的物质进行分析,得到如下表格:
时间/s 浓度/mol·L-1 | 0 | 20 | 40 | 60 | 80 | 100 |
c(N2O4) | 0.100 | c1 | 0.050 | c3 | a | b |
c(NO2) | 0.000 | 0.060 | c2 | 0.120 | 0.120 | 0.120 |
试填空:
(1)该反应的化学方程式为_______________________________________;达到平衡时四氧化二氮的转化率为_____% ;表中 c2_____c3____a____b(选填“ > ”、“ < ”、“ = ”)。
(2)20s时四氧化二氮的浓度 c1=________mol·L-1,在0s~20s内四氧化二氮的平均反应速率为_______mol·(L·s)-1;
(3)若在相同情况下最初向该容器充入的是二氧化氮气体,要达到上述同样的平衡状态,二氧化氮的起始浓度是____mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有反应:mA(g)+nB(g) ![]() pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数减小,则:
pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数减小,则:
(1)该反应的逆反应为______(填“吸热”或“放热”)反应,且m+n______(填“>”“=”或“<”)p。
(2)减压使容器体积增大时,A的质量分数________。(填“增大”“减小”或“不变”,下同)
(3)若容积不变加入B,则A的转化率__________,B的转化率________。
(4)若升高温度,则平衡时B、C的浓度之比![]() 将________。
将________。
(5)若加入催化剂,平衡时气体混合物的总物质的量______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有反应A(g)+B(g)![]() 2C(g),已知1molA与1molB反应达平衡时生成0.4molC.
2C(g),已知1molA与1molB反应达平衡时生成0.4molC.
(1)同温同压下,2molA与2molB反应达平衡时生成_______molC。
(2)恒温恒容下,2molA与2molB反应达平衡时生成_______molC。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中不正确的是
A. 可逆反应设计成双液电池,当反应达平衡时,外电路上没有电流通过
B. 将 NO2、N2O4 平衡混合气体的体积压缩为原来的一半,新平衡后气体颜色加深
C. 利用盖斯定律,可以计算某些难以直接测量的反应焓变
D. 抗腐蚀的金属一定排在金属活动性顺序表氢元素之后
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家设计出质子膜H2S燃料电池,实现了利用H2S废气资源回收能量并得到单质硫。质子膜H2S燃料电池的结构示意图如图所示。下列说法不正确的是( )
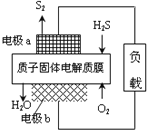
A. 电极a为电池的负极
B. 电极b上发生的电极反应为:O2+4H++4e-═2H2O
C. 电路中每流过2mol电子,在正极消耗22.4L H2S
D. 每34g H2S参与反应,有2mol H+经质子膜进入正极区
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com