
【题目】在100℃时,将0.100mol的四氧化二氮气体充入1L 抽空的密闭容器中,隔一定时间对该容器内的物质进行分析,得到如下表格:
时间/s 浓度/mol·L-1 | 0 | 20 | 40 | 60 | 80 | 100 |
c(N2O4) | 0.100 | c1 | 0.050 | c3 | a | b |
c(NO2) | 0.000 | 0.060 | c2 | 0.120 | 0.120 | 0.120 |
试填空:
(1)该反应的化学方程式为_______________________________________;达到平衡时四氧化二氮的转化率为_____% ;表中 c2_____c3____a____b(选填“ > ”、“ < ”、“ = ”)。
(2)20s时四氧化二氮的浓度 c1=________mol·L-1,在0s~20s内四氧化二氮的平均反应速率为_______mol·(L·s)-1;
(3)若在相同情况下最初向该容器充入的是二氧化氮气体,要达到上述同样的平衡状态,二氧化氮的起始浓度是____mol·L-1。
【答案】N2O4![]() 2NO260 > = =0.0700.00150.200
2NO260 > = =0.0700.00150.200
【解析】
(1).由表中数据可知,60s时反应达到平衡,根据反应方程式N2O4![]() 2NO2计算△c(N2O4),进而计算平衡时N2O4的转化率;60s后反应达到平衡,反应混合物各组分的浓度不变;(2).20s时四氧化二氮的浓度=起始浓度-△c(N2O4),根据v=
2NO2计算△c(N2O4),进而计算平衡时N2O4的转化率;60s后反应达到平衡,反应混合物各组分的浓度不变;(2).20s时四氧化二氮的浓度=起始浓度-△c(N2O4),根据v=![]() 计算在0s~20s内四氧化二氮的平均反应速率;(3).达到上述同样的平衡状态,为等效平衡,按化学计量数换算到四氧化二氮一边,满足c(N2O4)=0.100mol/L。
计算在0s~20s内四氧化二氮的平均反应速率;(3).达到上述同样的平衡状态,为等效平衡,按化学计量数换算到四氧化二氮一边,满足c(N2O4)=0.100mol/L。
(1).四氧化二氮生成二氧化氮的化学方程式为N2O4![]() 2NO2,由表中数据可知,60s时反应达平衡,c(NO2)=0.120mol/L,
2NO2,由表中数据可知,60s时反应达平衡,c(NO2)=0.120mol/L,
N2O4 ![]() 2NO2
2NO2
浓度变化:0.060mol/L 0.120mol/L
所以平衡时N2O4的转化率为![]() ×100%=60%,60s后反应达到平衡,反应混合物各组分的浓度不变,所以c3=a=b=(0.100-0.060)mol/L=0.040mol/L,40s时c(N2O4)=0.050mol/L,由化学方程式可知,此时c(NO2)=(0.100-0.050)mol/L×2=0.100mol/L,所以c2=0.100mol/L>c3=a=b=0.040mol/L,故答案为:N2O4
×100%=60%,60s后反应达到平衡,反应混合物各组分的浓度不变,所以c3=a=b=(0.100-0.060)mol/L=0.040mol/L,40s时c(N2O4)=0.050mol/L,由化学方程式可知,此时c(NO2)=(0.100-0.050)mol/L×2=0.100mol/L,所以c2=0.100mol/L>c3=a=b=0.040mol/L,故答案为:N2O4 ![]() 2NO2;60;>;=;=;
2NO2;60;>;=;=;
(2).由表中数据可知,20s时,c(NO2)=0.060mol/L,则
N2O4 ![]() 2NO2,
2NO2,
浓度变化:0.030mol/L 0.060mol/L
所以20s四氧化二氮的浓度c1=0.100mol/L0.030mol/L=0.070mol/L;在0s20s内四氧化二氮的平均反应速率为v(N2O4)=![]() =0.0015mol/(Ls),故答案为:0.070;0.0015;
=0.0015mol/(Ls),故答案为:0.070;0.0015;
(3). 若在相同情况下最初向该容器充入的是二氧化氮气体,要达到上述同样的平衡状态,为等效平衡,按化学计量数换算到N2O4一边,要满足c(N2O4)=0.100mol/L,则
N2O4 ![]() 2NO2,
2NO2,
0.100mol/L 0.200mol/L,故答案为:0.200。


科目:高中化学 来源: 题型:
【题目】碳是形成化合物种类最多的元素,其单质及化合物是人类生产生活的主要能源物质。
请回答下列问题:
(1)有机物M经过太阳光光照可转化成N,转化过程如下:
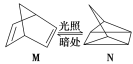 ΔH=+88.6 kJ·mol-1
ΔH=+88.6 kJ·mol-1
则M、N相比,较稳定的是 。
(2)已知CH3OH(l)的燃烧热为238.6 kJ·mol-1,CH3OH(l)+![]() O2(g)=CO2(g)+2H2(g) ΔH=-a kJ·mol-1,则a 238.6(填“>”、“<”或“=”)。
O2(g)=CO2(g)+2H2(g) ΔH=-a kJ·mol-1,则a 238.6(填“>”、“<”或“=”)。
(3)使Cl2和H2O(g)通过灼热的炭层,生成HCl和CO2,当有1 mol Cl2参与反应时释放出145 kJ热量,写出该反应的热化学方程式: 。
(4)火箭和导弹表面的薄层是耐高温物质。将石墨、铝粉和二氧化钛按一定比例混合在高温下煅烧,所得物质可作耐高温材料,4Al(s)+3TiO2(s)+3C(s)=2Al2O3(s)+3TiC(s) ΔH=-1 176 kJ·mol-1,则反应过程中,每转移1 mol电子放出的热量为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素a、b、c、d、e的原子序数依次增大,b是地壳中含量最高的元素,e的单质的熔点在同周期元素中最高,a、b的原子序数之和等于e的原子序数,d原子的核外电子层数等于最外层电子数:分别向cdb2溶液、c2eb3溶液中通入气体ab2,产生沉淀的质量与通入气体的体积的定性关系都可用右图表示。下列说法不正确的是
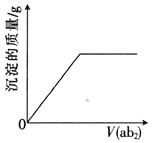
A. 原子半径:c>d>e>a>b
B. 工业上通常采用ab高温还原d2b3的方法冶炼d的单质
C. 同温下,0.1mol·L-1c2eb3溶液的pH大于0.1mol·L-1c2ab3溶液
D. 简单氢化物的热稳定性:b>a>e
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】《本草纲目》中的“石碱”条目下写道:“采蒿蓼之属,晒干烧灰,以水淋汁,久则凝淀如石,浣衣发面,亦去垢发面。”下列说法错误的是
A. “石碱”中含有离子键 B. “石碱”中含有极性共价键
C. “石碱”是离子化合物 D. “石碱”中含有非极性共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝及其合金在生活、生产中有广泛应用。
(1)最新研究表明:氢氧化铝溶于氢氧化钠溶液中生成Na[Al(OH)4]。则氢氧化铝在水中发生酸式电离的电离方程式为________________________________。
(2)目前,国内对真空碳热还原-氯化法冶炼铝的研究较多,利用该方法冶炼金属铝,既节能又环保。
已知:①Al2O3(s)+AlCl3(g)+3C(s)=====3AlCl(g)+3CO(g) △H1
②3AlCl(g)====2Al(l)+AlCl3(g) △H2
③Al(l)====Al(s) △H3
则Al2O3(s)+3C(s)====2Al(s)+3CO(g) △H4=___________(用含△H1、△H2、△H3的代数式表示)。
(3)已知:Al4C3是真空碳热还原-氯化法冶炼铝的中间产物,它与水反应生成气体Y,Y是含氢量最大的烃。向2L恒容密闭容器中充入2mol Y和2mol水蒸气,一定条件下发生反应a Y(g)+bH2O(g) ![]() c CO(g)+dH2(g) △H。测得Y的平衡转化率α(Y)与温度、压强的关系如图所示。
c CO(g)+dH2(g) △H。测得Y的平衡转化率α(Y)与温度、压强的关系如图所示。
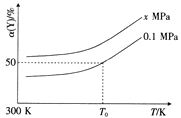
①上述反应的△H_______0(填“>”“<”或“=”)。
②图象中,x_________0.1(填“>”“<”或“=”)。
③在T0K、0.1MPa时,上述反应的平衡常数K=____________。
④提高上述反应的反应速率的措施有_______________________________ (任填二项)。
⑤从上述反应体系中分离出H2(还含有少量CO)作为合成氨的原料气,为避免CO使催化剂中毒,原料气在通入合成塔之前需与适量NH3混合,并用[Cu(NH3)2]Ac溶液吸收CO,反应原理为[Cu(NH3)2]Ac(aq)+CO(g)+NH3(g) ![]() [Cu(NH3)3]Ac·CO(aq) △H<0。若从温度、压强两方面考虑,用[Cu(NH3)2]Ac溶液吸收CO的适宜条件是________________________。
[Cu(NH3)3]Ac·CO(aq) △H<0。若从温度、压强两方面考虑,用[Cu(NH3)2]Ac溶液吸收CO的适宜条件是________________________。
(4)我国首创的海水电池以铝板为负极,以接触空气的铁铂合金网为正极,以弱碱性的海水为电解质溶液,电池总反应为4Al+3O2+6H2O===4Al(OH)3。试写出海水电池的正极反应式:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将氯气通入70℃的氢氧化钠水溶液中,能同时发生两个自身氧化还原反应(未配平):NaOH+Cl2→NaCl+NaClO+H2O,反应完成后测得溶液中NaClO与NaClO3的数目之比为5:2,则该溶液中NaCl与NaClO的数目之比为( )
A.3:1B.2:1C.15:2D.1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从铝土矿(主要成分是Al2O3,含SiO2、Fe2O3、MgO等杂质)中提取氧化铝两种工艺流程如下:
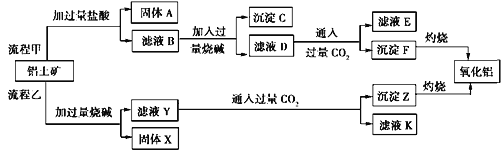
注:SiO2在“碱溶”时转化为铝硅酸钠沉淀。
请回答下列问题:
(1)验证滤液B含Fe3+,可取少量滤液并加入__________(填试剂名称)。
(2)滤液E、K中溶质的主要成份是________(填化学式),写出该溶质的一种用途____________。
(3)流程甲加入盐酸后生成Al3+的离子方程式为________。
(4)流程乙加入烧碱后生成SiO![]() 的离子方程式为____________________________。
的离子方程式为____________________________。
(5)滤液D中通过量CO2产生沉淀F的离子方程式:___________________________。
(6)已知298K时,Mg(OH)2的溶度积常数Ksp=5.6×10-12,取适量的滤液B,加入一定量的烧碱至达到沉淀溶解平衡,测得pH=13,则此温度下残留在溶液中的c(Mg2+)=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将4 mol A气体和2 mol B气体充入2 L的密闭容器中,一定条件下发生如下反应:2A(g)+B(g)![]() 2C(g)。若经2 s后测得C的浓度为0.6 mol/L,下列几种说法正确的是
2C(g)。若经2 s后测得C的浓度为0.6 mol/L,下列几种说法正确的是
①用物质A表示的反应平均速率为0.3 mol/(L·s)
②用物质B表示的反应的平均速率为0.6 mol/(L·s)
③2 s时物质A的转化率为70%
④2 s时物质B的浓度为0.7 mol/L
A. ①③ B. ①④ C. ②③ D. ③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向浓度均为 0.1 molL-1、体积均为 100 mL 的两种一元酸 HX、HY的溶液中,分别加入 NaOH固体,lg[c(H+ )/c(OH- )]随加入 NaOH的物质的量的变化如图所示。下列说法正确的是

A. 常温下电离常数:HX < HY![]()
B. a 点由水电离出的 c(H+)=10-12 molL-1
C. c 点溶液中:c(Y- )>c(HY )![]()
D. b 点时酸碱恰好完全中和
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com