
【题目】铝及其合金在生活、生产中有广泛应用。
(1)最新研究表明:氢氧化铝溶于氢氧化钠溶液中生成Na[Al(OH)4]。则氢氧化铝在水中发生酸式电离的电离方程式为________________________________。
(2)目前,国内对真空碳热还原-氯化法冶炼铝的研究较多,利用该方法冶炼金属铝,既节能又环保。
已知:①Al2O3(s)+AlCl3(g)+3C(s)=====3AlCl(g)+3CO(g) △H1
②3AlCl(g)====2Al(l)+AlCl3(g) △H2
③Al(l)====Al(s) △H3
则Al2O3(s)+3C(s)====2Al(s)+3CO(g) △H4=___________(用含△H1、△H2、△H3的代数式表示)。
(3)已知:Al4C3是真空碳热还原-氯化法冶炼铝的中间产物,它与水反应生成气体Y,Y是含氢量最大的烃。向2L恒容密闭容器中充入2mol Y和2mol水蒸气,一定条件下发生反应a Y(g)+bH2O(g) ![]() c CO(g)+dH2(g) △H。测得Y的平衡转化率α(Y)与温度、压强的关系如图所示。
c CO(g)+dH2(g) △H。测得Y的平衡转化率α(Y)与温度、压强的关系如图所示。
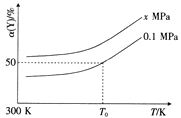
①上述反应的△H_______0(填“>”“<”或“=”)。
②图象中,x_________0.1(填“>”“<”或“=”)。
③在T0K、0.1MPa时,上述反应的平衡常数K=____________。
④提高上述反应的反应速率的措施有_______________________________ (任填二项)。
⑤从上述反应体系中分离出H2(还含有少量CO)作为合成氨的原料气,为避免CO使催化剂中毒,原料气在通入合成塔之前需与适量NH3混合,并用[Cu(NH3)2]Ac溶液吸收CO,反应原理为[Cu(NH3)2]Ac(aq)+CO(g)+NH3(g) ![]() [Cu(NH3)3]Ac·CO(aq) △H<0。若从温度、压强两方面考虑,用[Cu(NH3)2]Ac溶液吸收CO的适宜条件是________________________。
[Cu(NH3)3]Ac·CO(aq) △H<0。若从温度、压强两方面考虑,用[Cu(NH3)2]Ac溶液吸收CO的适宜条件是________________________。
(4)我国首创的海水电池以铝板为负极,以接触空气的铁铂合金网为正极,以弱碱性的海水为电解质溶液,电池总反应为4Al+3O2+6H2O===4Al(OH)3。试写出海水电池的正极反应式:________。
【答案】 Al(OH)3+H2O![]() [Al(OH)4]+H ΔH1+ΔH2+2ΔH3 > < 6.75 mol2·L2 使用催化剂、增大反应物浓度、升高温度 低温、高压 O2+4e+2H2O===4OH
[Al(OH)4]+H ΔH1+ΔH2+2ΔH3 > < 6.75 mol2·L2 使用催化剂、增大反应物浓度、升高温度 低温、高压 O2+4e+2H2O===4OH
【解析】(1)氢氧化铝在水中发生酸式电离的电离方程式为 Al(OH)3+H2O![]() [Al(OH)4]+H ;(2)①Al2O3(s)+AlCl3(g)+3C(s)=====3AlCl(g)+3CO(g) △H1,②3AlCl(g)====2Al(l)+AlCl3(g) △H2,③Al(l)====Al(s) △H3,由盖斯定律,①+②+2③,则Al2O3(s)+3C(s)====2Al(s)+3CO(g) △H4=ΔH1+ΔH2+2ΔH3 ;(3)Al4C3是真空碳热还原-氯化法冶炼铝的中间产物,它与水反应生成气体Y,Y是含氢量最大的烃。Y为CH4①由图可知:升高温度,平衡转化率α(Y)增大,a Y(g)+bH2O(g)
[Al(OH)4]+H ;(2)①Al2O3(s)+AlCl3(g)+3C(s)=====3AlCl(g)+3CO(g) △H1,②3AlCl(g)====2Al(l)+AlCl3(g) △H2,③Al(l)====Al(s) △H3,由盖斯定律,①+②+2③,则Al2O3(s)+3C(s)====2Al(s)+3CO(g) △H4=ΔH1+ΔH2+2ΔH3 ;(3)Al4C3是真空碳热还原-氯化法冶炼铝的中间产物,它与水反应生成气体Y,Y是含氢量最大的烃。Y为CH4①由图可知:升高温度,平衡转化率α(Y)增大,a Y(g)+bH2O(g) ![]() c CO(g)+dH2(g),平衡正向移动,上述反应的△H>0;②向2L恒容密闭容器中充入2mol Y和2mol水蒸气,一定条件下发生反应a Y(g)+bH2O(g)
c CO(g)+dH2(g),平衡正向移动,上述反应的△H>0;②向2L恒容密闭容器中充入2mol Y和2mol水蒸气,一定条件下发生反应a Y(g)+bH2O(g) ![]() c CO(g)+dH2(g) ,该反应为 CH4(g)+1H2O(g)
c CO(g)+dH2(g) ,该反应为 CH4(g)+1H2O(g) ![]() 1CO(g)+3H2(g) ,由图平衡转化率α(Y)增大,平衡正向移动,再根据方程式的计量数,平衡向正向移动,应是减小压强,故图象中,x<0.1;
1CO(g)+3H2(g) ,由图平衡转化率α(Y)增大,平衡正向移动,再根据方程式的计量数,平衡向正向移动,应是减小压强,故图象中,x<0.1;
③在T0K、0.1MPa时,平衡转化率α(Y)=0.5时
CH4(g)+1H2O(g) ![]() 1CO(g)+3H2(g)
1CO(g)+3H2(g)
c始 1 1
c变 0.5 0.5 0.5 1.5
c平 0.5 0.5 0.5 1.5
上述反应的平衡常数K=![]() =6.75 mol2·L2。
=6.75 mol2·L2。
④提高上述反应的反应速率的措施有使用催化剂、增大反应物浓度、升高温度等(任填二项)。⑤[Cu(NH3)2]Ac(aq)+CO(g)+NH3(g) ![]() [Cu(NH3)3]Ac·CO(aq) △H<0。若从温度、压强两方面考虑,用[Cu(NH3)2]Ac溶液吸收CO的适宜条件是:低温和高压,低温和高压条件下,气体溶解度大。(4)氧气在正极得电子,被还原,海水电池的正极反应式: O2+4e+2H2O===4OH。
[Cu(NH3)3]Ac·CO(aq) △H<0。若从温度、压强两方面考虑,用[Cu(NH3)2]Ac溶液吸收CO的适宜条件是:低温和高压,低温和高压条件下,气体溶解度大。(4)氧气在正极得电子,被还原,海水电池的正极反应式: O2+4e+2H2O===4OH。


科目:高中化学 来源: 题型:
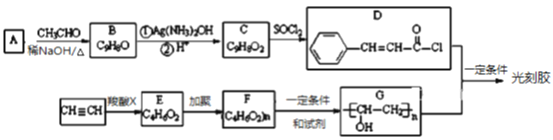
【题目】光刻胶是一种应用广泛的光敏材料,其合成路线如下(部分试剂和产物略去):
已知Ⅰ.![]() (R,R′为烃基或氢)
(R,R′为烃基或氢)
Ⅱ. ![]()
Ⅲ.![]() (R,R′为烃基)
(R,R′为烃基)
(1)写出A的结构简式_____________、C的结构简式:_____________。
(2)由B生成C的反应试剂还可以选用_____________________。
(3)由B到C的反应类型为_____________。由F到G的反应类型为_____________。
(4)D和G反应生成光刻胶的化学方程式为_________________________________________________。
(5)写出由A生成B的化学反应方程式:___________________________________________________。
(6)C的一种同分异构体满足下列条件:
①能发生银镜反应,其水解产物之一能与FeCl3溶液发生显色反应;
②苯环上的一氯取代产物只有两种。写出该同分异构体的结构简式:_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了探究化学能与热能的转化,某实验小组设计了如下三套实验装置:
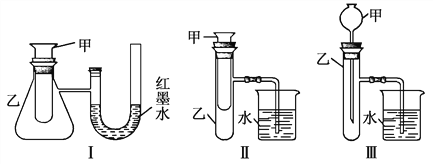
(1)上述3个装置中,不能证明“铜与浓硝酸反应是吸热反应还是放热反应”的是___________________。
(2)某同学选用装置Ⅰ进行实验(实验前U形管里液面左右相平),在甲试管里加入适量氢氧化钡溶液与稀硫酸,U形管中可观察到的现象是___________________,说明该反应属于___________________(填“吸热”或“放热”)反应。
(3)为探究固体M溶于水的热效应,选择装置Ⅱ进行实验(反应在甲中进行)。
①若M为钠,则实验过程中烧杯中可观察到的现象是___________________;
②若观察到烧杯里产生气泡,则说明M溶于水___________________ (填“一定是放热反应”“一定是吸热反应”或“可能是放热反应”),理由是___________________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据图中包含的信息分析,下列叙述正确的是 ( )
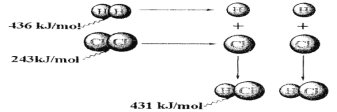
A.氢气与氯气反应生成1 mol氯化氢气体,反应吸收248 kJ的能量
B.436 kJ/mol是指断开1 mol H2中的H-H键需要放出436 kJ的能量
C.氢气与氯气反应生成2 mol氯化氢气体,反应放出183 kJ的能量
D.431kJ/mol是指生成2 mol HCl中的H-Cl键需要放出431 kJ的能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应不属于取代反应的是( )
A. C2H4+Cl2![]() C2H4Cl2 B. 2C2H5OH
C2H4Cl2 B. 2C2H5OH![]() C2H5—O—C2H5+H2O
C2H5—O—C2H5+H2O
C. C2H5Cl+H2O![]() C2H5OH+HCl D. CH4+4Cl2
C2H5OH+HCl D. CH4+4Cl2![]() CCl4+4HCl
CCl4+4HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.对于4FeS2+11O2═2Fe2O3+8SO2,试回答有关的问题:
(1)常选用哪些物质浓度的变化来表示该反应的速率____________;
(2)为了提高生成SO2的速率,可以采取的措施是______________;
A.增加FeS2的量 B.增大O2的浓度 C.升高温度 D.减小压强
Ⅱ.某可逆反应在某体积为5L的密闭容器中进行,在从0﹣3分钟各物质的量的变化情况如图所示(A,B,C均为气体)
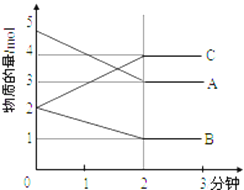
(3)该反应的化学方程式为_________________;
(4)在一定温度下,体积不变的密闭容器中,上述反应达到平衡的标志是_______________
A.气体总质量保持不变
B.A、B、C的浓度都相等
C.A、B、C的浓度不再发生变化
D.A、B、C的分子数之比为2:1:2
E.正反应和逆反应都已停止
F.容器内气体密度不再发生变化.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属钒及其化合物有着广泛的应用,现有如下回收利用含钒催化剂[含有V2O5、VOSO4(强电解质)及不溶性残渣]的工艺的主要流程:

部分含钒物质在水中的溶解性如下表所示:
物质 | VOSO4 | V2O5 | NH4VO3 | (VO2)2SO4 | HVO3 |
溶解性 | 可溶 | 难溶 | 难溶 | 易溶 | 难溶 |
请回答下列问题:
(1)工业上常用铝热反应由V2O5冶炼金属钒,化学方程式为__________。
(2)反应①、②、③、④中,发生氧化还原反应的是__________(填序号),写出反应①的离子方程式____。操作1、操作2用到的玻璃仪器是___________。
(3)反应③的沉淀率(又称沉钒率)是回收钒的关键之一,下图是反应温度与沉钒率的关系图,则控制温度的方法是_____________。

(4)反应④在焙烧过程中随温度的升高发生了两步反应。已知234gNH4VO3固体质量的减少值△W随温度(T)变化的曲线如图。试写出300℃~350℃时反应的化学方程式___________。
(5)全钒电池的电解质溶液为VOSO4溶液,电池的工作原理为VO2++V2++2H+![]() VO2++H2O+V3+。电池充电时阳极的电极反应式为____________。
VO2++H2O+V3+。电池充电时阳极的电极反应式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸常用于金属表面除锈.(原理:Fe2O3+3H2SO4═Fe2(SO4)3+3H2O)
(1)把50g质量分数为98%的浓硫酸,稀释成10%的稀硫酸,需要水的质量是多少?
(2)要使16gFe2O3恰好完全反应,需消耗上述10%的稀硫酸的质量是多少?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肼是一种常见的还原剂,不同条件下分解产物不同,60~300℃时,在Cu等金属表面肼分解的机理如下图所示,已知200℃时:Ⅰ.3N2H4(g)= N2(g)+4NH3(g) ΔH1=-32.9kJ·mol-1;
Ⅱ.N2H4(g)+H2(g)= 2NH3(g) ΔH2=-41.8kJ·mol-1。
下列说法不正确的是

A. 肼属于共价化合物
B. 图示过程①、②都是吸热反应
C. 反应Ⅰ中氧化剂与还原剂的物质的量之比为2∶1
D. 200℃时,肼分解的热化学方程式为N2H4(g)= N2(g)+2H2(g) ΔH=+50.7kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com