
【题目】光刻胶是一种应用广泛的光敏材料,其合成路线如下(部分试剂和产物略去):
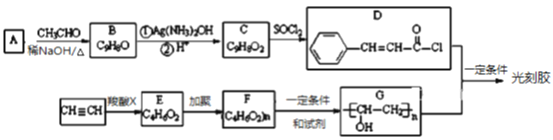
已知Ⅰ.![]() (R,R′为烃基或氢)
(R,R′为烃基或氢)
Ⅱ. ![]()
Ⅲ.![]() (R,R′为烃基)
(R,R′为烃基)
(1)写出A的结构简式_____________、C的结构简式:_____________。
(2)由B生成C的反应试剂还可以选用_____________________。
(3)由B到C的反应类型为_____________。由F到G的反应类型为_____________。
(4)D和G反应生成光刻胶的化学方程式为_________________________________________________。
(5)写出由A生成B的化学反应方程式:___________________________________________________。
(6)C的一种同分异构体满足下列条件:
①能发生银镜反应,其水解产物之一能与FeCl3溶液发生显色反应;
②苯环上的一氯取代产物只有两种。写出该同分异构体的结构简式:_____________。
【答案】 ![]()
![]() 新制氢氧化铜悬浊液 氧化反应 水解反应
新制氢氧化铜悬浊液 氧化反应 水解反应 ![]()
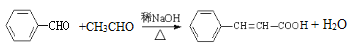
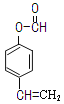
【解析】试题分析:由题中合成路线和信息I可知,A为苯甲醛,B为3-苯基丙烯醛;B经银氨溶液氧化、酸化后得到C,则C为3-苯基丙烯酸;由信息II可知,C与SOCl2发生取代反应生成D;乙炔经一系列转化变为G,由G可逆推出F为![]() ,所以F到G发生了酯的水解反应;由信息III可知,G与D发生取代反应生成
,所以F到G发生了酯的水解反应;由信息III可知,G与D发生取代反应生成![]() 。
。
(1)A的结构简式为![]() 、C的结构简式为
、C的结构简式为![]() 。
。
(2)由B生成C的反应是醛基的氧化反应,新制的氢氧化铜悬浊液也可以把醛基氧化为羧基,所以反应试剂还可以选用新制氢氧化铜悬浊液。
(3)由B到C的反应类型为氧化反应。由F到G的反应类型为水解反应。
(4)根据信息III,可知D和G反应生成光刻胶的化学方程式为:![]() 。
。
(5)由信息I可知,由A生成B的化学反应方程式为:![]() 。
。
(6)C(![]() )的一种同分异构体满足下列条件:①能发生银镜反应,其水解产物之一能与FeCl3溶液发生显色反应,则该同分异构体分子中有醛基,其水解后的产物中有酚羟基,所以该有机物可能为甲酸与酚形成的酯;②苯环上的一氯取代产物只有两种,则苯环上有两个互为对位的取代基。综上所述,该同分异构体的结构简式为:
)的一种同分异构体满足下列条件:①能发生银镜反应,其水解产物之一能与FeCl3溶液发生显色反应,则该同分异构体分子中有醛基,其水解后的产物中有酚羟基,所以该有机物可能为甲酸与酚形成的酯;②苯环上的一氯取代产物只有两种,则苯环上有两个互为对位的取代基。综上所述,该同分异构体的结构简式为: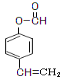 。
。


科目:高中化学 来源: 题型:
【题目】如图为元素周期表截取的短周期的一部分,四种元素均不是稀有气体元素。下列关于这四种元素及其化合物的说法中正确的是 ( )
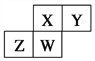
A. 原子半径:W>Z>Y>X
B. 气态氢化物的稳定性:Z>W>X>Y
C. W的最高正化合价与负化合价的绝对值一定不相等
D. Z的最高价氧化物的水化物可能为弱酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图表示某种有机物的结构,关于它的性质叙述中正确的是( )
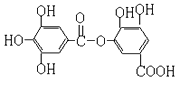
A. 1mol该有机物在一定条件下,能与7molH2发生加成反应
B. 不能与FeCl3溶液作用发生显色反应
C. 能与NaHCO3反应放出气体
D. 1mol该有机物在一定条件下,能与7molNaOH反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如图,下列表述中正确的是( ) 
A.反应的化学方程式为:2MN
B.t2时,正逆反应速率相等,达到平衡
C.t3时,正反应速率大于逆反应速率
D.t1时,N的浓度是M浓度的2倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室提纯含少量氯化钠杂质的硝酸钾的过程如图所示.下列分析正确的是( ) 
A.操作Ⅰ是过滤,将固体分离除去
B.操作Ⅱ是加热浓缩.趁热过滤,除去杂质氯化钠
C.操作Ⅲ是过滤、洗涤,将硝酸钾晶体从溶液中分离出来
D.操作Ⅰ~Ⅲ总共需两次过滤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温、容积为2L的密闭容器中通入1molN2和xmolH2发生如下反应:N2(g)+3H2(g)![]() 2NH3(g)。经过5min达到平衡时,混合气体的物质的量为3.6mol,容器内的压强变为原来的90%。试回答(请书写必要的计算步骤):
2NH3(g)。经过5min达到平衡时,混合气体的物质的量为3.6mol,容器内的压强变为原来的90%。试回答(请书写必要的计算步骤):
(1)起始时充入H2的物质的量_________;
(2)平衡时N2的浓度_______;
(3)5min内用NH3表示的化学反应速率__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,两电极一为碳棒,一为铁片,若电流表的指针发生偏转,且a极上有大量气泡生成,则以下叙述正确的是

A. a为负极,是铁片,烧杯中的溶液为硫酸
B. b为负极,是铁片,烧杯中的溶液为硫酸铜溶液
C. a为正极,是碳棒,烧杯中的溶液为硫酸
D. b为正极,是碳棒,烧杯中的溶液为硫酸铜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃和1.01×105Pa时,反应2N2O5(g)═4NO2(g)+O2(g)△H=+56.76kJ/mol,自发进行的原因是( )
A.是吸热反应
B.是放热反应
C.是熵减少的反应
D.熵增大效应大于能量效应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝及其合金在生活、生产中有广泛应用。
(1)最新研究表明:氢氧化铝溶于氢氧化钠溶液中生成Na[Al(OH)4]。则氢氧化铝在水中发生酸式电离的电离方程式为________________________________。
(2)目前,国内对真空碳热还原-氯化法冶炼铝的研究较多,利用该方法冶炼金属铝,既节能又环保。
已知:①Al2O3(s)+AlCl3(g)+3C(s)=====3AlCl(g)+3CO(g) △H1
②3AlCl(g)====2Al(l)+AlCl3(g) △H2
③Al(l)====Al(s) △H3
则Al2O3(s)+3C(s)====2Al(s)+3CO(g) △H4=___________(用含△H1、△H2、△H3的代数式表示)。
(3)已知:Al4C3是真空碳热还原-氯化法冶炼铝的中间产物,它与水反应生成气体Y,Y是含氢量最大的烃。向2L恒容密闭容器中充入2mol Y和2mol水蒸气,一定条件下发生反应a Y(g)+bH2O(g) ![]() c CO(g)+dH2(g) △H。测得Y的平衡转化率α(Y)与温度、压强的关系如图所示。
c CO(g)+dH2(g) △H。测得Y的平衡转化率α(Y)与温度、压强的关系如图所示。
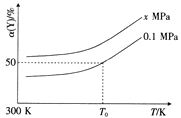
①上述反应的△H_______0(填“>”“<”或“=”)。
②图象中,x_________0.1(填“>”“<”或“=”)。
③在T0K、0.1MPa时,上述反应的平衡常数K=____________。
④提高上述反应的反应速率的措施有_______________________________ (任填二项)。
⑤从上述反应体系中分离出H2(还含有少量CO)作为合成氨的原料气,为避免CO使催化剂中毒,原料气在通入合成塔之前需与适量NH3混合,并用[Cu(NH3)2]Ac溶液吸收CO,反应原理为[Cu(NH3)2]Ac(aq)+CO(g)+NH3(g) ![]() [Cu(NH3)3]Ac·CO(aq) △H<0。若从温度、压强两方面考虑,用[Cu(NH3)2]Ac溶液吸收CO的适宜条件是________________________。
[Cu(NH3)3]Ac·CO(aq) △H<0。若从温度、压强两方面考虑,用[Cu(NH3)2]Ac溶液吸收CO的适宜条件是________________________。
(4)我国首创的海水电池以铝板为负极,以接触空气的铁铂合金网为正极,以弱碱性的海水为电解质溶液,电池总反应为4Al+3O2+6H2O===4Al(OH)3。试写出海水电池的正极反应式:________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com