
【题目】科学家设计出质子膜H2S燃料电池,实现了利用H2S废气资源回收能量并得到单质硫。质子膜H2S燃料电池的结构示意图如图所示。下列说法不正确的是( )
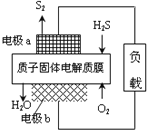
A. 电极a为电池的负极
B. 电极b上发生的电极反应为:O2+4H++4e-═2H2O
C. 电路中每流过2mol电子,在正极消耗22.4L H2S
D. 每34g H2S参与反应,有2mol H+经质子膜进入正极区
科目:高中化学 来源: 题型:
【题目】将氯气通入70℃的氢氧化钠水溶液中,能同时发生两个自身氧化还原反应(未配平):NaOH+Cl2→NaCl+NaClO+H2O,反应完成后测得溶液中NaClO与NaClO3的数目之比为5:2,则该溶液中NaCl与NaClO的数目之比为( )
A.3:1B.2:1C.15:2D.1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.某温度时,在容积为2L的密闭容器中,X、Y、Z三种物质的物质的量随时间变化的曲线如图所示,请回答:
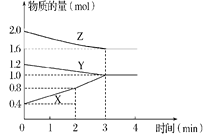
(1)该反应的化学方程式为_________(用X、Y、Z表示)。
(2)从反应开始至2 min末,X的平均反应速率为___________________。
(3)该反应由________(填字母序号)开始的。
A 正反应 B 逆反应 C 正、逆反应同时
(4)其他条件不变,只增加Y的用量,若该反应的速率不发生变化,则Y为___________态。
Ⅱ. 亚硫酸钠和碘酸钾在酸性溶液中反应的化学方程式为 5Na2SO3+2KIO3+H2SO4 = 5Na2SO4+K2SO4+I2+H2O,该反应的机理较复杂,一般认为分以下几步:
①IO3- + SO32-→ IO2- + SO42-(慢); ②IO2- + SO32-→ IO- + SO42-(快);
③5I-+ 6H+ + IO3- →3I2 +3H2O(快); ④I2 + SO32- + H2O →2I- +SO42- + 2H+(快)。
(1)据此推测,该反应的总反应速率由__________步反应决定。
(2)若预先在酸性溶液中加入淀粉溶液,当_________离子(填对应离子符号)反应完时溶液才会变蓝。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜的冶炼大致可分为以下几个步骤:
(1)富集,将硫化物矿进行浮选;
(2)焙烧,主要反应为![]()
![]()
![]() (炉渣);
(炉渣);
(3)制粗铜,在1200℃的条件下发生的主要反应为![]()
![]()
![]() ,
,![]()
![]()
![]() ;
;
(4)电解精炼。
下列说法不正确的是
A. 上述焙烧过程中的尾气不可直接排放
B. 由6mol![]() 生成6molCu时,在整个过程中共消耗15mol
生成6molCu时,在整个过程中共消耗15mol![]()
C. 在反应中![]()
![]()
![]() ,只有
,只有![]() 作氧化剂
作氧化剂
D. 电解精炼属于化学变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向浓度均为 0.1 molL-1、体积均为 100 mL 的两种一元酸 HX、HY的溶液中,分别加入 NaOH固体,lg[c(H+ )/c(OH- )]随加入 NaOH的物质的量的变化如图所示。下列说法正确的是

A. 常温下电离常数:HX < HY![]()
B. a 点由水电离出的 c(H+)=10-12 molL-1
C. c 点溶液中:c(Y- )>c(HY )![]()
D. b 点时酸碱恰好完全中和
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】双氧水、84消毒液是日常生活中常用的消毒剂。
(1)84消毒液(主要成分是NaClO)溶液呈碱性,用离子方程式表示其原因:_____________________。
(2)双氧水和84消毒液混合失去消毒作用,并产生无色无味气体,在该反应中氧化剂是____________。
(3)工业上,制备84消毒液的原理是:以惰性电极电解饱和氯化钠溶液,产生的氯气用生成的烧碱溶液吸收。阴极发生的电极反应式为_________________________;写出总反应的化学方程式______________。
(4)实验室分别用KMnO4、H2O2、KClO3制备O2,当得到等质量的O2时,各反应中转移电子的数目之比为______________。
(5)双氧水是二元弱酸,298 K时,Ka1=1.6×1012,Ka2=1.0×1025。则298 K时,0.1 mol·L1双氧水溶液的pH≈________________。(已知:lg2≈0.3)
(6)将V2O5溶于足量稀硫酸得到250mL(VO2)2SO4溶液。取25.00mL该溶液于锥形瓶中,用0.1000 mol·L-1H2C2O4标准溶液进行滴定,达到滴定终点时消耗标准溶液的体积为20.00mL。已知滴定过程中H2C2O4被氧化为CO2,VO2+(黄色)被还原为VO2+(蓝色)。
①该滴定实验不需要另外加入指示剂,达到滴定终点的现象是___________________。
②(VO2)2SO4溶液中溶质的物质的量浓度为___________________。
③达到滴定终点时,仰视滴定管读数将使结果_________(填“偏高”、“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子组合中,能大量共存的是
A. Cu2+、Mg2+、OH-、SO42- B. H+、Ag+、Cl-、NO3-
C. Na+、K+、SO42-、Cl- D. Ba2+、H+、Cl-、CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.实验室应将钠保存在煤油中B.清洗完的分液漏斗和容量瓶都要干燥
C.可用酒精代替CCl4萃取碘水中的碘单质D.二氧化碳是酸雨的主要成分
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】50mL0.50 mol·L-1的盐酸与50mL0.55 mol·L-1的NaOH溶液在如图所示的装置中进行中和反应。实验数据如下表:
实验序号 | 起始温度t1/℃ | 终止温度t2/℃ | |
盐酸 | NaOH溶液 | 混合溶液 | |
1 | 20.0 | 20.1 | 23.2 |
2 | 20.2 | 20.4 | 23.4 |
3 | 20.5 | 20.6 | 23.6 |

近似认为0.50 mol·L-1NaOH溶液和0.50 mol·L-1HCl溶液的密度都是1g·cm-3,中和后生成溶液的比热容c=4.18 J·g-1·℃-1。
请回答下列问题:从实验装置上看,图中尚缺少的一种玻璃仪器是________,烧杯间填满碎泡沫塑料的作用是_____________。大烧杯上如不盖硬纸板,则求得的中和热数值_______(填“偏大” “偏小”或“无影响”)。则中和热ΔH=________(取小数点后一位)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com