
【题目】50mL0.50 mol·L-1的盐酸与50mL0.55 mol·L-1的NaOH溶液在如图所示的装置中进行中和反应。实验数据如下表:
实验序号 | 起始温度t1/℃ | 终止温度t2/℃ | |
盐酸 | NaOH溶液 | 混合溶液 | |
1 | 20.0 | 20.1 | 23.2 |
2 | 20.2 | 20.4 | 23.4 |
3 | 20.5 | 20.6 | 23.6 |

近似认为0.50 mol·L-1NaOH溶液和0.50 mol·L-1HCl溶液的密度都是1g·cm-3,中和后生成溶液的比热容c=4.18 J·g-1·℃-1。
请回答下列问题:从实验装置上看,图中尚缺少的一种玻璃仪器是________,烧杯间填满碎泡沫塑料的作用是_____________。大烧杯上如不盖硬纸板,则求得的中和热数值_______(填“偏大” “偏小”或“无影响”)。则中和热ΔH=________(取小数点后一位)。
【答案】环形玻璃搅拌棒 保温隔热,防止热量散失 偏小 -51.8 kJ·mol-1
【解析】
根据图示可知该装置是(简易)量热计;进行酸碱中和热的测定,为了减少实验误差,要使酸、碱快速反应,根据图示可知缺少的仪器是环形玻璃搅拌棒;中和热测定实验成败的关键是保温措施,大小烧杯之间填满碎泡沫塑料的作用是减少实验过程中的热量损失;如大烧杯上不盖硬纸板,则有反应放出的热量会散失,造成结果偏小;根据表中数据可知,温度的差值依次为(℃)3.15、3.1、3.05,因此温度差的平均值是(3.15+3.1+3.05)℃÷3=3.1℃,反应中生成0.025mol水,所以反应热△H=-0.00418×3.1×100÷0.025=-51.8 kJ/mol。故答案为:环形玻璃搅拌棒;保温隔热,防止热量散失;偏小;-51.8 kJ·mol-1。


科目:高中化学 来源: 题型:
【题目】科学家设计出质子膜H2S燃料电池,实现了利用H2S废气资源回收能量并得到单质硫。质子膜H2S燃料电池的结构示意图如图所示。下列说法不正确的是( )
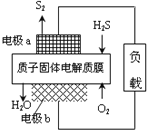
A. 电极a为电池的负极
B. 电极b上发生的电极反应为:O2+4H++4e-═2H2O
C. 电路中每流过2mol电子,在正极消耗22.4L H2S
D. 每34g H2S参与反应,有2mol H+经质子膜进入正极区
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙三个容器中充入一定量的A和B,发生反应:A(g)+xB(g) ![]() 2C(g)。各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以下表和下图表示:
2C(g)。各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以下表和下图表示:
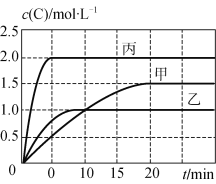
容器 | 甲 | 乙 | 丙 |
容积 | 0.5 L | 0.5 L | 1.0 L |
温度/℃ | T1 | T2 | T2 |
反应物 起始量 | 1.5 molA 0.5 molB | 1.5 molA 0.5 molB | 6.0 molA 2.0 molB |
下列说法正确的是
A. 10 min内甲容器中反应的平均速率v(A)=0.025 mol·L-1·min-1
B. 由图可知:T1<T2,且该反应为吸热反应
C. 若平衡时保持温度不变,改变容器体积平衡不移动
D. T1℃,起始时甲容器中充入0.5 molA、1.5 molB,平衡时A的转化率为25%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据叙述,写出下列反应的热化学方程式.
(1)若适量的N2和O2完全反应,每生成23gNO2需要吸收16.95kJ热量![]() 其热化学方程式为______.
其热化学方程式为______.
(2)已知1g液态乙醇(C2H5OH)完全燃烧生成CO2气体和液态水时,放出29.7kJ的热量,写出乙醇燃烧热的热化学方程式为 ______ .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化氯(ClO2)是极易溶于水且不与水发生化学反应的黄绿色气体,沸点为11℃,可用于处理含硫废水。某小组在实验室中探究ClO2与Na2S的反应。请回答下列问题:
(1)ClO2的制备(已知:SO2+2NaClO3+H2SO4=2ClO2+2NaHSO4)
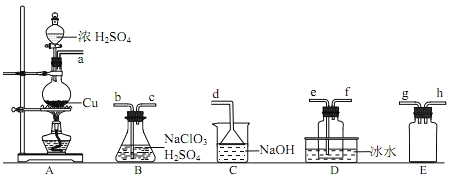
①装置A中反应的化学方程式为_____________。
②欲收集一定量的ClO2,选择上图中的装置,其连接顺序为a______(按气流方向,用小写字母表示)。
(2)ClO2与Na2S的反应
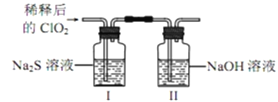
将上述收集到的ClO2用N2稀释以增强其稳定性,并将适量的稀释后的ClO2通入上图所示装置中充分反应,得到无色澄清溶液。一段时间后,通过下列实验探究Ⅰ中反应的产物。__
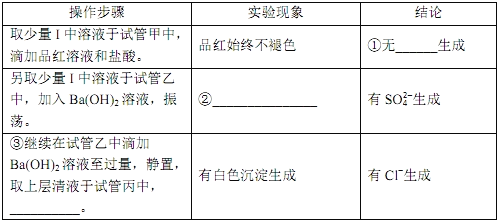
④ClO2与Na2S的反应的离子方程式为__________。用于处理含硫废水时,ClO2相对于Cl2的优点是________(任写一条)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】焦亚硫酸钠(Na2S2O5)是的食品抗氧化剂之一。某研究小组进行如下实验:
实验一 焦亚硫酸钠的制取
采用如图装置(实验前除尽装置内的空气)制取Na2S2O5。装置Ⅱ中有Na2S2O5晶体析出,发生的反应为Na2SO3 + SO2 = Na2S2O5。
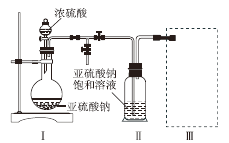
⑴ 装置Ⅰ中产生气体的化学方程式为________________________________;
⑵ 上图中盛装浓硫酸的玻璃仪器的名称是:__________________________;
⑶ 装置Ⅲ用于处理尾气,可选用的最合理装置(夹持仪器已略去)为_________(填序号)。
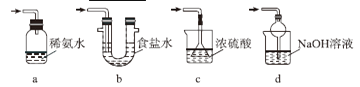
实验二 焦亚硫酸钠的性质(Na2S2O5溶于水即生成NaHSO3)
⑷ 证明NaHSO3溶液中HSO![]() 的电离程度大于水解程度,可采用的实验方法是___________(填序号)。
的电离程度大于水解程度,可采用的实验方法是___________(填序号)。
a.测定溶液的pH b.加入Ba(OH)2溶液 c.加入盐酸
d.加入品红溶液 e.用蓝色石蕊试纸检测
实验三 葡萄酒中抗氧化剂残留量的测定
⑸ 葡萄酒常用Na2S2O5作抗氧化剂。测定葡萄酒中抗氧化剂的残留量(以游离SO2计算)的方案如下:(滴定时反应为SO2 + I2 + 2H2O = H2SO4 + 2HI)

①上述滴定过程中的终点现象为______________________________________;
②按上述方案实验,消耗标准I2溶液25.00 mL,该次实验测得样品中抗氧化剂的残留量(以游离SO2计算)为____________g·L-1。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com