
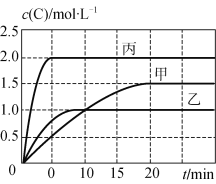
【题目】甲、乙、丙三个容器中充入一定量的A和B,发生反应:A(g)+xB(g) ![]() 2C(g)。各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以下表和下图表示:
2C(g)。各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以下表和下图表示:
容器 | 甲 | 乙 | 丙 |
容积 | 0.5 L | 0.5 L | 1.0 L |
温度/℃ | T1 | T2 | T2 |
反应物 起始量 | 1.5 molA 0.5 molB | 1.5 molA 0.5 molB | 6.0 molA 2.0 molB |
下列说法正确的是
A. 10 min内甲容器中反应的平均速率v(A)=0.025 mol·L-1·min-1
B. 由图可知:T1<T2,且该反应为吸热反应
C. 若平衡时保持温度不变,改变容器体积平衡不移动
D. T1℃,起始时甲容器中充入0.5 molA、1.5 molB,平衡时A的转化率为25%
【答案】C
【解析】
试题A、由图可知,10min内甲容器中C的浓度变化量为1mol/L,v(C)=1mol/L÷10min=0.1mol/(Lmin)。由于速率之比等于化学计量数之比,所以v(A)=0.1mol/(Lmin)÷2=0.05mol/(Lmin),A错误;B、比较甲与乙可知,乙先到达平衡,故温度T1<T2,温度越高C的浓度越低,升高温度平衡向逆反应移动,故正反应为放热反应,B错误;C、乙中平衡时C的浓度是1.0mol/L,则根据方程式可知,消耗A的浓度是0.5mol/L,物质的量是0.5mol/L×0.5L=0.25mol,所以A的转化率为![]() =
=![]() ;丙中平衡时C的浓度是2.0mol/L,则根据方程式可知,消耗A的浓度是1.0mol/L,物质的量是1.0mol/L×1L=1.0mol,所以A的转化率为
;丙中平衡时C的浓度是2.0mol/L,则根据方程式可知,消耗A的浓度是1.0mol/L,物质的量是1.0mol/L×1L=1.0mol,所以A的转化率为![]() =
=![]() A。丙中压强为乙中2倍,压强增大平衡不移动,故x=1,C正确;D、
A。丙中压强为乙中2倍,压强增大平衡不移动,故x=1,C正确;D、
A(g)+B(g)![]() 2C(g)
2C(g)
起始浓度(mol/L) 3 1 0
转化浓度(mol/L) 0.75 0.75 1.5
平衡浓度(mol/L) 2.25 0.25 1.5
故T1℃,该反应的平衡常数为K=![]() =4
=4
令T1℃,起始时甲容器中充入0.5molA、1.5molB,反应到达平衡时A的浓度变化量为x,则
A(g)+B(g)![]() 2C(g)
2C(g)
起始浓度(mol/L) 1 3 0
转化浓度(mol/L) x x 2x
平衡浓度(mol/L) 1-x 3-x 2x
所以![]() =4
=4
解得x=0.75
所以故A的转化率=![]() ×100%=75%,D不正确,答案选C。
×100%=75%,D不正确,答案选C。


科目:高中化学 来源: 题型:
【题目】Ⅰ.某温度时,在容积为2L的密闭容器中,X、Y、Z三种物质的物质的量随时间变化的曲线如图所示,请回答:
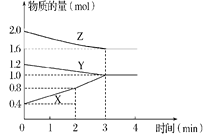
(1)该反应的化学方程式为_________(用X、Y、Z表示)。
(2)从反应开始至2 min末,X的平均反应速率为___________________。
(3)该反应由________(填字母序号)开始的。
A 正反应 B 逆反应 C 正、逆反应同时
(4)其他条件不变,只增加Y的用量,若该反应的速率不发生变化,则Y为___________态。
Ⅱ. 亚硫酸钠和碘酸钾在酸性溶液中反应的化学方程式为 5Na2SO3+2KIO3+H2SO4 = 5Na2SO4+K2SO4+I2+H2O,该反应的机理较复杂,一般认为分以下几步:
①IO3- + SO32-→ IO2- + SO42-(慢); ②IO2- + SO32-→ IO- + SO42-(快);
③5I-+ 6H+ + IO3- →3I2 +3H2O(快); ④I2 + SO32- + H2O →2I- +SO42- + 2H+(快)。
(1)据此推测,该反应的总反应速率由__________步反应决定。
(2)若预先在酸性溶液中加入淀粉溶液,当_________离子(填对应离子符号)反应完时溶液才会变蓝。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子组合中,能大量共存的是
A. Cu2+、Mg2+、OH-、SO42- B. H+、Ag+、Cl-、NO3-
C. Na+、K+、SO42-、Cl- D. Ba2+、H+、Cl-、CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.实验室应将钠保存在煤油中B.清洗完的分液漏斗和容量瓶都要干燥
C.可用酒精代替CCl4萃取碘水中的碘单质D.二氧化碳是酸雨的主要成分
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据叙述,写出下列反应的热化学方程式。
(1)在25 ℃、101 kPa下,1 g甲醇燃烧生成CO2和液态水时放热22.68 kJ。则表示甲醇燃烧热的热化学方程式为_____________________________。
(2)若适量的N2和O2完全反应,每生成23 g NO2需要吸收16.95 kJ热量。其热化学方程式为________________________________________________________________________。
(3)用NA表示阿伏加德罗常数,在C2H2(气态)完全燃烧生成CO2和液态水的反应中,每有5NA个电子转移时,放出650 kJ的热量。其热化学方程式为_______________。
(4)已知拆开1 mol H—H键、1 mol N—H键、1 mol N≡N键分别需要的能量是436 kJ、391 kJ、946 kJ,则N2与H2反应生成NH3的热化学方程式为______________。
(5)某次发射火箭,用N2H4(肼)在NO2中燃烧,生成N2、液态H2O。已知: N2(g)+2O2(g)==2NO2(g) ΔH1=+67.2kJ/mol N2H4(g)+O2(g)==N2(g)+2H2O(l) ΔH2=-534kJ/mol假如都在相同状态下,请写出发射火箭反应的热化学方程式。_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应A(g)+3B(g) ![]() 2C(g)+D(g) 在四种不同情况下的反应速率如下,其中反应进行得最快的是( )
2C(g)+D(g) 在四种不同情况下的反应速率如下,其中反应进行得最快的是( )
A.VA=0.15mol(Lmin)﹣1 B.VB=0.6 mol(Lmin)﹣1
C.VC=0.4 mol(Lmin)﹣1 D.VD=0.01 mol(Ls)﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】50mL0.50 mol·L-1的盐酸与50mL0.55 mol·L-1的NaOH溶液在如图所示的装置中进行中和反应。实验数据如下表:
实验序号 | 起始温度t1/℃ | 终止温度t2/℃ | |
盐酸 | NaOH溶液 | 混合溶液 | |
1 | 20.0 | 20.1 | 23.2 |
2 | 20.2 | 20.4 | 23.4 |
3 | 20.5 | 20.6 | 23.6 |

近似认为0.50 mol·L-1NaOH溶液和0.50 mol·L-1HCl溶液的密度都是1g·cm-3,中和后生成溶液的比热容c=4.18 J·g-1·℃-1。
请回答下列问题:从实验装置上看,图中尚缺少的一种玻璃仪器是________,烧杯间填满碎泡沫塑料的作用是_____________。大烧杯上如不盖硬纸板,则求得的中和热数值_______(填“偏大” “偏小”或“无影响”)。则中和热ΔH=________(取小数点后一位)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下图海水综合利用的工业流程图,判断下列说法正确的是( )
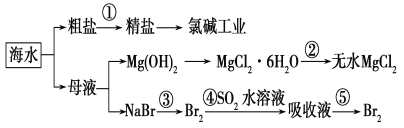
已知:MgCl2·6H2O受热生成Mg(OH)Cl和HCl气体等。
A. 除去粗盐中杂质(Mg2+、SO42-、Ca2+),加入的药品顺序为:NaOH溶液→Na2CO3溶液→BaCl2溶液→过滤后加盐酸
B. 在过程②中将MgCl2·6H2O灼烧即可制得无水MgCl2
C. 从能量角度来看,氯碱工业中的电解饱和食盐水是一个将化学能转化为电能的过程
D. 从第③步到第⑤步的目的是为了浓缩富集溴
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com