
【题目】下列离子组合中,能大量共存的是
A. Cu2+、Mg2+、OH-、SO42- B. H+、Ag+、Cl-、NO3-
C. Na+、K+、SO42-、Cl- D. Ba2+、H+、Cl-、CO32-
科目:高中化学 来源: 题型:
【题目】现有反应A(g)+B(g)![]() 2C(g),已知1molA与1molB反应达平衡时生成0.4molC.
2C(g),已知1molA与1molB反应达平衡时生成0.4molC.
(1)同温同压下,2molA与2molB反应达平衡时生成_______molC。
(2)恒温恒容下,2molA与2molB反应达平衡时生成_______molC。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向20 mL 0.5 mol·L-1的醋酸溶液中逐滴加入等物质的量浓度的烧碱溶液,测定混合溶液的温度变化如图所示。下列关于混合溶液的相关说法中错误的是

A. 醋酸的电离平衡常数:B点>A点
B. 由水电离出的c(OH-):B点>C点
C. 从A点到B点,混合溶液中可能存在:c(CH3COO-)=c(Na+)
D. 从B点到C点,混合溶液中一直存在:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家设计出质子膜H2S燃料电池,实现了利用H2S废气资源回收能量并得到单质硫。质子膜H2S燃料电池的结构示意图如图所示。下列说法不正确的是( )
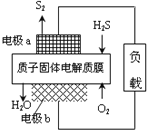
A. 电极a为电池的负极
B. 电极b上发生的电极反应为:O2+4H++4e-═2H2O
C. 电路中每流过2mol电子,在正极消耗22.4L H2S
D. 每34g H2S参与反应,有2mol H+经质子膜进入正极区
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列涉及有机物的说法正确的( )
A.乙烯、氯乙烯、苯乙烯都是不饱和烃,均可用于合成有机高分子材料
B.丙烷是一种清洁燃料,可用作燃料电池的燃料
C.苯能与溴发生取代反应,因此不能用苯萃取溴水中的溴
D.糖类、蛋白质、脂肪都是重要的营养物质,它们都属于高分子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钢铁行业是工业生产的重要支柱。
(1)已知高炉炼铁的主要反应为:
①Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) △H=-25 kJ·mol-1
②3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g) △H=-47 kJ·mol-1
③Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) △H=+19 kJ·mol-1
写出FeO(s)被CO还原生成Fe(s)和CO2的热化学方程式:________________。
(2)恒温恒容条件下进行反应Fe2O3(s)+3CO(g)![]() 2Fe(s)+3CO2(g),下列各项能说明该反应已达到平衡状态的是_______(填写序号字母)。
2Fe(s)+3CO2(g),下列各项能说明该反应已达到平衡状态的是_______(填写序号字母)。
a.v(CO)正=v(CO2)逆 b.CO、CO2 的浓度之比为1:1
c.容器内压强保持不变 d.混合气体的密度保持不变
(3)ToC时,反应Fe2O3(s)+3CO(g)![]() 2Fe(s)+3CO2(g)的平衡常数为K=27。在1L的密闭容器中分别按下表所示加入物质,维持ToC反应一段时间达到平衡,甲、乙容器中CO的平衡转化率之比=_________。
2Fe(s)+3CO2(g)的平衡常数为K=27。在1L的密闭容器中分别按下表所示加入物质,维持ToC反应一段时间达到平衡,甲、乙容器中CO的平衡转化率之比=_________。
Fe2O3 | CO | Fe | CO2 | |
甲容器 | 1.0 mol | 1.0 mol | 1.0 mol | 1.0 mol |
乙容器 | 1.0 mol | 2.0 mol | 1.0 mol | 1.0 mol |
(4)下列为合成甲醇的有关化学方程式:
①2H2(g)+CO(g) ![]() CH3OH(g)
CH3OH(g)
②H2(g)+CO2(g) ![]() H2O(g)+CO(g)
H2O(g)+CO(g)
③3H2(g)+CO2(g) ![]() CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
某温度下,上述三个反应的平衡常数数值分别为2.5,2.0和K3,则K3值为_______。
(5)比亚迪双模电动汽车使用高铁电池供电。高铁电池的总反应为:3Zn(OH)2+2Fe(OH)3+4KOH![]() 3Zn+2K2FeO4+8H2O,则充电时的阳极反应式为__________。
3Zn+2K2FeO4+8H2O,则充电时的阳极反应式为__________。
(6)炼铁尾气中含有CO,经过回收可用于合成甲醇:2H2(g)+CO(g)![]() CH3OH(g) △H=-90.1 kJ·mol-1。ToC,该反应的Kp=6.0×10-3kPa-2(用平衡分压代替平衡浓度所得平衡常数,分压= 总压×物质的量分数)。该温度下的某容器中,若起始充入2molH2、1molCO,平衡时甲醇的平衡分压p(CH3OH)=24.0kPa,则平衡时混合气体中CH3OH的体积分数约为________(用百分数表示,小数点后保留1位)。
CH3OH(g) △H=-90.1 kJ·mol-1。ToC,该反应的Kp=6.0×10-3kPa-2(用平衡分压代替平衡浓度所得平衡常数,分压= 总压×物质的量分数)。该温度下的某容器中,若起始充入2molH2、1molCO,平衡时甲醇的平衡分压p(CH3OH)=24.0kPa,则平衡时混合气体中CH3OH的体积分数约为________(用百分数表示,小数点后保留1位)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种熔融碳酸盐燃料电池原理示意如图。下列有关该电池的说法正确的是( )
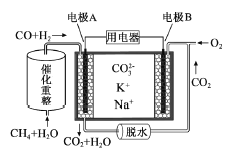
A. 反应CH4+H2O![]() 3H2+CO,每消耗1molCH4转移12mol 电子
3H2+CO,每消耗1molCH4转移12mol 电子
B. 电极A上H2参与的电极反应为:H2+2OH--2e-=2H2O
C. 电池工作时,CO32-向电极B移动
D. 电极B上发生的电极反应为:O2+2CO2+4e-=2CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙三个容器中充入一定量的A和B,发生反应:A(g)+xB(g) ![]() 2C(g)。各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以下表和下图表示:
2C(g)。各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以下表和下图表示:
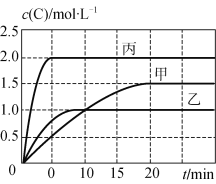
容器 | 甲 | 乙 | 丙 |
容积 | 0.5 L | 0.5 L | 1.0 L |
温度/℃ | T1 | T2 | T2 |
反应物 起始量 | 1.5 molA 0.5 molB | 1.5 molA 0.5 molB | 6.0 molA 2.0 molB |
下列说法正确的是
A. 10 min内甲容器中反应的平均速率v(A)=0.025 mol·L-1·min-1
B. 由图可知:T1<T2,且该反应为吸热反应
C. 若平衡时保持温度不变,改变容器体积平衡不移动
D. T1℃,起始时甲容器中充入0.5 molA、1.5 molB,平衡时A的转化率为25%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化氯(ClO2)是极易溶于水且不与水发生化学反应的黄绿色气体,沸点为11℃,可用于处理含硫废水。某小组在实验室中探究ClO2与Na2S的反应。请回答下列问题:
(1)ClO2的制备(已知:SO2+2NaClO3+H2SO4=2ClO2+2NaHSO4)
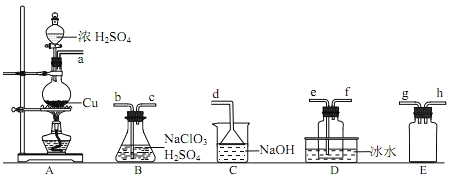
①装置A中反应的化学方程式为_____________。
②欲收集一定量的ClO2,选择上图中的装置,其连接顺序为a______(按气流方向,用小写字母表示)。
(2)ClO2与Na2S的反应
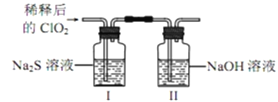
将上述收集到的ClO2用N2稀释以增强其稳定性,并将适量的稀释后的ClO2通入上图所示装置中充分反应,得到无色澄清溶液。一段时间后,通过下列实验探究Ⅰ中反应的产物。__
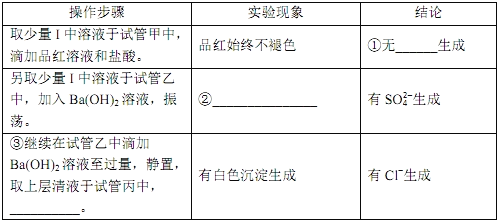
④ClO2与Na2S的反应的离子方程式为__________。用于处理含硫废水时,ClO2相对于Cl2的优点是________(任写一条)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com