
【题目】钢铁行业是工业生产的重要支柱。
(1)已知高炉炼铁的主要反应为:
①Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) △H=-25 kJ·mol-1
②3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g) △H=-47 kJ·mol-1
③Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) △H=+19 kJ·mol-1
写出FeO(s)被CO还原生成Fe(s)和CO2的热化学方程式:________________。
(2)恒温恒容条件下进行反应Fe2O3(s)+3CO(g)![]() 2Fe(s)+3CO2(g),下列各项能说明该反应已达到平衡状态的是_______(填写序号字母)。
2Fe(s)+3CO2(g),下列各项能说明该反应已达到平衡状态的是_______(填写序号字母)。
a.v(CO)正=v(CO2)逆 b.CO、CO2 的浓度之比为1:1
c.容器内压强保持不变 d.混合气体的密度保持不变
(3)ToC时,反应Fe2O3(s)+3CO(g)![]() 2Fe(s)+3CO2(g)的平衡常数为K=27。在1L的密闭容器中分别按下表所示加入物质,维持ToC反应一段时间达到平衡,甲、乙容器中CO的平衡转化率之比=_________。
2Fe(s)+3CO2(g)的平衡常数为K=27。在1L的密闭容器中分别按下表所示加入物质,维持ToC反应一段时间达到平衡,甲、乙容器中CO的平衡转化率之比=_________。
Fe2O3 | CO | Fe | CO2 | |
甲容器 | 1.0 mol | 1.0 mol | 1.0 mol | 1.0 mol |
乙容器 | 1.0 mol | 2.0 mol | 1.0 mol | 1.0 mol |
(4)下列为合成甲醇的有关化学方程式:
①2H2(g)+CO(g) ![]() CH3OH(g)
CH3OH(g)
②H2(g)+CO2(g) ![]() H2O(g)+CO(g)
H2O(g)+CO(g)
③3H2(g)+CO2(g) ![]() CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
某温度下,上述三个反应的平衡常数数值分别为2.5,2.0和K3,则K3值为_______。
(5)比亚迪双模电动汽车使用高铁电池供电。高铁电池的总反应为:3Zn(OH)2+2Fe(OH)3+4KOH![]() 3Zn+2K2FeO4+8H2O,则充电时的阳极反应式为__________。
3Zn+2K2FeO4+8H2O,则充电时的阳极反应式为__________。
(6)炼铁尾气中含有CO,经过回收可用于合成甲醇:2H2(g)+CO(g)![]() CH3OH(g) △H=-90.1 kJ·mol-1。ToC,该反应的Kp=6.0×10-3kPa-2(用平衡分压代替平衡浓度所得平衡常数,分压= 总压×物质的量分数)。该温度下的某容器中,若起始充入2molH2、1molCO,平衡时甲醇的平衡分压p(CH3OH)=24.0kPa,则平衡时混合气体中CH3OH的体积分数约为________(用百分数表示,小数点后保留1位)。
CH3OH(g) △H=-90.1 kJ·mol-1。ToC,该反应的Kp=6.0×10-3kPa-2(用平衡分压代替平衡浓度所得平衡常数,分压= 总压×物质的量分数)。该温度下的某容器中,若起始充入2molH2、1molCO,平衡时甲醇的平衡分压p(CH3OH)=24.0kPa,则平衡时混合气体中CH3OH的体积分数约为________(用百分数表示,小数点后保留1位)。
【答案】FeO(s)+CO(g)=Fe(s)+CO2(g) △H=-11kJ/mol ad 4:5 5.0 2Fe(OH)3+10OH--6e-=2FeO42-+8H2O 44.4%
【解析】
(1)根据盖斯定律计算;
(2)根据平衡状态的特征分析判断;
(3)根据平衡常数结合三段式计算;
(4)根据已知方程式进行叠加计算平衡常数;
(5)根据阳极发生得到电子的氧化反应分析解答;
(6)根据方程式和平衡常数的含义计算甲醇的体积分数。
(1)已知:
①Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) △H=-25 kJ·mol-1
②3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g) △H=-47 kJ·mol-1
③Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) △H=+19 kJ·mol-1
根据盖斯定律可知(①×3-②-③×2)/6即得到FeO(s)被CO还原生成Fe(s)和CO2的热化学方程式为FeO(s)+CO(g)==Fe(s)+CO2(g) △H=-11kJ/mol。
(2)在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态。则
a.v(CO)正=v(CO2)逆表示反应速率的方向相反,且满足反应速率之比是化学计量数之比,反应达到平衡状态,a正确;
b.CO、CO2的浓度之比为1:1不能说明正逆反应速率相等,不一定达到平衡状态,b错误;
c.反应前后体积不变,容器内压强保持不变不能说明反应达到平衡状态,c错误;
d.密度是混合气的质量和容器容积的比值,在反应过程中容积始终是不变的,但质量是变化的,则混合气体的密度保持不变说明反应达到平衡状态,d正确。
答案选ad;
(3)甲容器中 Fe2O3(s)+3CO(g)![]() 2Fe(s)+3CO2(g)
2Fe(s)+3CO2(g)
起始浓度(mol/L) 1 1
转化浓度(mol/L) x x
平衡浓度(mol/L) 1-x 1+x
乙容器中 Fe2O3(s)+3CO(g)![]() 2Fe(s)+3CO2(g)
2Fe(s)+3CO2(g)
起始浓度(mol/L) 2 1
转化浓度(mol/L) y y
平衡浓度(mol/L) 2-y 1+y
则![]() 、
、![]()
解得x=0.5、y=1.25,即甲中转化为是50%,乙中转化率为62.5%,所以甲、乙容器中CO的平衡转化率之比50%:62.5%=4:5;
(4)已知:
①2H2(g)+CO(g)![]()
②H2(g)+CO2(g)![]() H2O(g)+CO(g) K2
H2O(g)+CO(g) K2
③3H2(g)+CO2(g)![]() CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
①+②即得到反应③,则K3=K1×K2=2.5×2.0=5.0;
(5)高铁电池的总反应为3Zn(OH)2+2Fe(OH)3+4KOH![]() 3Zn+2K2FeO4+8H2O,充电时氢氧化铁失去电子转化为高铁酸钾,则充电时的阳极反应式为2Fe(OH)3+10OH--6e-=2FeO42-+8H2O。
3Zn+2K2FeO4+8H2O,充电时氢氧化铁失去电子转化为高铁酸钾,则充电时的阳极反应式为2Fe(OH)3+10OH--6e-=2FeO42-+8H2O。
(6)起始时投入2molH2、1molCO,二者按2:1反应,故平衡时二者物质的量之比为2:1,二者分压之比为2:1,设平衡时CO分压为P,则氢气分压为2P,该反应的平衡常数Kp=6.0×10-3(kPa)-2,反应达到平衡时p(CH3OH)=24.0kPa,则![]() ,解得P=10kPa,相同条件下,压强之比等于物质的量之比,故平衡时H2、CO、CH3OH的物质的量之比为20:10:24=10:5:12,则平衡混合气体中CH3OH的物质的量分数为12/(10+5+12)×100%≈44.4%。
,解得P=10kPa,相同条件下,压强之比等于物质的量之比,故平衡时H2、CO、CH3OH的物质的量之比为20:10:24=10:5:12,则平衡混合气体中CH3OH的物质的量分数为12/(10+5+12)×100%≈44.4%。


科目:高中化学 来源: 题型:
【题目】A~G为中学化学中常见的物质,B、E、F为单质,在常温下B是一种有色气体,G为黑色固体。它们的相互转化如图所示,部分生成物未列出。试回答下列问题:
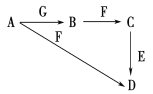
(1)F的一种氧化物常用作红色油漆和涂料,这种氧化物的俗称为________。
(2)E在电气、电子工业中应用最广,也是人类发现最早的金属之一。写出E与C反应的离子方程式________,利用电解法可提纯E物质,在该电解反应中阳极物质是________,阴极物质是________,电解质溶液是__。
(3)写出下列物质的化学式:A________、G________。
(4)将B与SO2等体积混合后,通入品红溶液中,观察到的现象是__________,涉及的离子方程式为______,工业上获得B的重要途径是________(用化学方程式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜的冶炼大致可分为以下几个步骤:
(1)富集,将硫化物矿进行浮选;
(2)焙烧,主要反应为![]()
![]()
![]() (炉渣);
(炉渣);
(3)制粗铜,在1200℃的条件下发生的主要反应为![]()
![]()
![]() ,
,![]()
![]()
![]() ;
;
(4)电解精炼。
下列说法不正确的是
A. 上述焙烧过程中的尾气不可直接排放
B. 由6mol![]() 生成6molCu时,在整个过程中共消耗15mol
生成6molCu时,在整个过程中共消耗15mol![]()
C. 在反应中![]()
![]()
![]() ,只有
,只有![]() 作氧化剂
作氧化剂
D. 电解精炼属于化学变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】双氧水、84消毒液是日常生活中常用的消毒剂。
(1)84消毒液(主要成分是NaClO)溶液呈碱性,用离子方程式表示其原因:_____________________。
(2)双氧水和84消毒液混合失去消毒作用,并产生无色无味气体,在该反应中氧化剂是____________。
(3)工业上,制备84消毒液的原理是:以惰性电极电解饱和氯化钠溶液,产生的氯气用生成的烧碱溶液吸收。阴极发生的电极反应式为_________________________;写出总反应的化学方程式______________。
(4)实验室分别用KMnO4、H2O2、KClO3制备O2,当得到等质量的O2时,各反应中转移电子的数目之比为______________。
(5)双氧水是二元弱酸,298 K时,Ka1=1.6×1012,Ka2=1.0×1025。则298 K时,0.1 mol·L1双氧水溶液的pH≈________________。(已知:lg2≈0.3)
(6)将V2O5溶于足量稀硫酸得到250mL(VO2)2SO4溶液。取25.00mL该溶液于锥形瓶中,用0.1000 mol·L-1H2C2O4标准溶液进行滴定,达到滴定终点时消耗标准溶液的体积为20.00mL。已知滴定过程中H2C2O4被氧化为CO2,VO2+(黄色)被还原为VO2+(蓝色)。
①该滴定实验不需要另外加入指示剂,达到滴定终点的现象是___________________。
②(VO2)2SO4溶液中溶质的物质的量浓度为___________________。
③达到滴定终点时,仰视滴定管读数将使结果_________(填“偏高”、“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子组合中,能大量共存的是
A. Cu2+、Mg2+、OH-、SO42- B. H+、Ag+、Cl-、NO3-
C. Na+、K+、SO42-、Cl- D. Ba2+、H+、Cl-、CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学利用氧化还原反应:2KMnO4+10FeSO4+8H2SO4=2MnSO4+5Fe2(SO4)3+K2SO4 +8H2O设计如下原电池,盐桥中装有饱和KCl溶液。下列说法正确的是
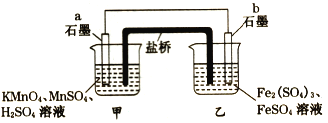
A. b电极上发生还原反应
B. 外电路电子的流向是从a到b
C. 电池工作时,盐桥中的SO42-移向甲烧杯
D. a电极上发生的反应为:MnO4-+8H++5e- = Mn2++4H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.实验室应将钠保存在煤油中B.清洗完的分液漏斗和容量瓶都要干燥
C.可用酒精代替CCl4萃取碘水中的碘单质D.二氧化碳是酸雨的主要成分
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应A(g)+3B(g) ![]() 2C(g)+D(g) 在四种不同情况下的反应速率如下,其中反应进行得最快的是( )
2C(g)+D(g) 在四种不同情况下的反应速率如下,其中反应进行得最快的是( )
A.VA=0.15mol(Lmin)﹣1 B.VB=0.6 mol(Lmin)﹣1
C.VC=0.4 mol(Lmin)﹣1 D.VD=0.01 mol(Ls)﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把在空气中久置的铝片5.0 g投入盛有500 mL 0.5 mol·L-1硫酸溶液的烧杯中,该铝片与硫酸反应产生氢气的速率v与反应时间t可用如图坐标曲线来表示。下列推论错误的是( )
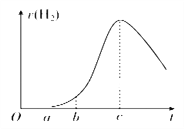
A. O~a段不产生氢气是因为表面的氧化物隔离了铝和硫酸溶液
B. b~c段产生氢气的速率增加较快的主要原因之一是温度升高
C. t>c时产生氢气的速率降低主要是因为溶液中c(H+)降低
D. t=c时反应处于平衡状态
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com