
【题目】现有反应A(g)+B(g)![]() 2C(g),已知1molA与1molB反应达平衡时生成0.4molC.
2C(g),已知1molA与1molB反应达平衡时生成0.4molC.
(1)同温同压下,2molA与2molB反应达平衡时生成_______molC。
(2)恒温恒容下,2molA与2molB反应达平衡时生成_______molC。
【答案】0.80.8
【解析】
该反应为等体积的可逆反应,根据等效平衡原理判断各小题。
(1). A(g)+B(g) ![]() 2C(g)为等体积的可逆反应,同温同压下,开始时通入2molA和2molB与开始时通入1molA和1molB,A与B的物质的量之比均为1:1,为等效平衡,达到平衡后各物质的物质的量分数不变,所以同温同压下,2molA与2molB反应达平衡时生成0.8molC,故答案为:0.8;
2C(g)为等体积的可逆反应,同温同压下,开始时通入2molA和2molB与开始时通入1molA和1molB,A与B的物质的量之比均为1:1,为等效平衡,达到平衡后各物质的物质的量分数不变,所以同温同压下,2molA与2molB反应达平衡时生成0.8molC,故答案为:0.8;
(2). A(g)+B(g)![]() 2C(g)为等体积的可逆反应,恒温恒容下,开始时通入2molA和2molB与开始时通入1molA和1molB,A与B的物质的量之比均为1:1,为等效平衡,达到平衡后各物质的物质的量分数不变,所以恒温恒容下,2molA与2molB反应达平衡时生成0.8molC,故答案为:0.8。
2C(g)为等体积的可逆反应,恒温恒容下,开始时通入2molA和2molB与开始时通入1molA和1molB,A与B的物质的量之比均为1:1,为等效平衡,达到平衡后各物质的物质的量分数不变,所以恒温恒容下,2molA与2molB反应达平衡时生成0.8molC,故答案为:0.8。


 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案科目:高中化学 来源: 题型:
【题目】(1)许多运动会使用的火炬内熊熊大火来源于丙烷的燃烧,丙烷是一种优良的燃料。试回答下列问题:
①如图是一定量丙烷完全燃烧生成CO2和1 mol H2O过程中的能量变化图,请在图中的括号内填入“+”或“-”。
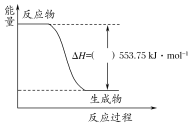
②写出表示丙烷燃烧热的热化学方程式:____________________________________________。
(2)2SO2(g)+O2(g)![]() 2SO3(g)反应过程的能量变化如图所示。已知1 mol SO2(g)氧化为1 mol SO3(g)的ΔH=﹣99 kJmol-1。
2SO3(g)反应过程的能量变化如图所示。已知1 mol SO2(g)氧化为1 mol SO3(g)的ΔH=﹣99 kJmol-1。
请回答下列问题:
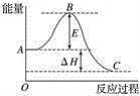
①图中ΔH=______kJmol-1。
②已知单质硫的燃烧热为296 kJmol-1,计算由S(s)生成1 mol SO3(g)的ΔH=______ kJmol-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】《本草纲目》中的“石碱”条目下写道:“采蒿蓼之属,晒干烧灰,以水淋汁,久则凝淀如石,浣衣发面,亦去垢发面。”下列说法错误的是
A. “石碱”中含有离子键 B. “石碱”中含有极性共价键
C. “石碱”是离子化合物 D. “石碱”中含有非极性共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将氯气通入70℃的氢氧化钠水溶液中,能同时发生两个自身氧化还原反应(未配平):NaOH+Cl2→NaCl+NaClO+H2O,反应完成后测得溶液中NaClO与NaClO3的数目之比为5:2,则该溶液中NaCl与NaClO的数目之比为( )
A.3:1B.2:1C.15:2D.1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从铝土矿(主要成分是Al2O3,含SiO2、Fe2O3、MgO等杂质)中提取氧化铝两种工艺流程如下:
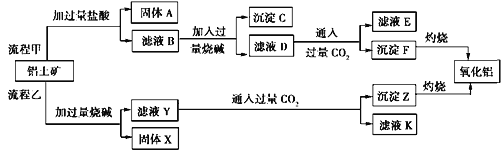
注:SiO2在“碱溶”时转化为铝硅酸钠沉淀。
请回答下列问题:
(1)验证滤液B含Fe3+,可取少量滤液并加入__________(填试剂名称)。
(2)滤液E、K中溶质的主要成份是________(填化学式),写出该溶质的一种用途____________。
(3)流程甲加入盐酸后生成Al3+的离子方程式为________。
(4)流程乙加入烧碱后生成SiO![]() 的离子方程式为____________________________。
的离子方程式为____________________________。
(5)滤液D中通过量CO2产生沉淀F的离子方程式:___________________________。
(6)已知298K时,Mg(OH)2的溶度积常数Ksp=5.6×10-12,取适量的滤液B,加入一定量的烧碱至达到沉淀溶解平衡,测得pH=13,则此温度下残留在溶液中的c(Mg2+)=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A~G为中学化学中常见的物质,B、E、F为单质,在常温下B是一种有色气体,G为黑色固体。它们的相互转化如图所示,部分生成物未列出。试回答下列问题:
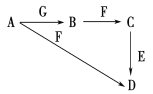
(1)F的一种氧化物常用作红色油漆和涂料,这种氧化物的俗称为________。
(2)E在电气、电子工业中应用最广,也是人类发现最早的金属之一。写出E与C反应的离子方程式________,利用电解法可提纯E物质,在该电解反应中阳极物质是________,阴极物质是________,电解质溶液是__。
(3)写出下列物质的化学式:A________、G________。
(4)将B与SO2等体积混合后,通入品红溶液中,观察到的现象是__________,涉及的离子方程式为______,工业上获得B的重要途径是________(用化学方程式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将4 mol A气体和2 mol B气体充入2 L的密闭容器中,一定条件下发生如下反应:2A(g)+B(g)![]() 2C(g)。若经2 s后测得C的浓度为0.6 mol/L,下列几种说法正确的是
2C(g)。若经2 s后测得C的浓度为0.6 mol/L,下列几种说法正确的是
①用物质A表示的反应平均速率为0.3 mol/(L·s)
②用物质B表示的反应的平均速率为0.6 mol/(L·s)
③2 s时物质A的转化率为70%
④2 s时物质B的浓度为0.7 mol/L
A. ①③ B. ①④ C. ②③ D. ③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.某温度时,在容积为2L的密闭容器中,X、Y、Z三种物质的物质的量随时间变化的曲线如图所示,请回答:
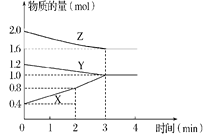
(1)该反应的化学方程式为_________(用X、Y、Z表示)。
(2)从反应开始至2 min末,X的平均反应速率为___________________。
(3)该反应由________(填字母序号)开始的。
A 正反应 B 逆反应 C 正、逆反应同时
(4)其他条件不变,只增加Y的用量,若该反应的速率不发生变化,则Y为___________态。
Ⅱ. 亚硫酸钠和碘酸钾在酸性溶液中反应的化学方程式为 5Na2SO3+2KIO3+H2SO4 = 5Na2SO4+K2SO4+I2+H2O,该反应的机理较复杂,一般认为分以下几步:
①IO3- + SO32-→ IO2- + SO42-(慢); ②IO2- + SO32-→ IO- + SO42-(快);
③5I-+ 6H+ + IO3- →3I2 +3H2O(快); ④I2 + SO32- + H2O →2I- +SO42- + 2H+(快)。
(1)据此推测,该反应的总反应速率由__________步反应决定。
(2)若预先在酸性溶液中加入淀粉溶液,当_________离子(填对应离子符号)反应完时溶液才会变蓝。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子组合中,能大量共存的是
A. Cu2+、Mg2+、OH-、SO42- B. H+、Ag+、Cl-、NO3-
C. Na+、K+、SO42-、Cl- D. Ba2+、H+、Cl-、CO32-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com