
【题目】银锌纽扣电池,其电池的电池反应式为Zn+ Ag2O+H2O =Zn(OH)2+2Ag。据此判断氧化银是 ( )
A.负极,并被氧化B.正极,并被还原
C.负极,并被还原D.正极,并被氧化
科目:高中化学 来源: 题型:
【题目】据报道,磷酸二氢钾(KH2PO4)大晶体已应用于我国研制的巨型激光器“神光二号”中。利用氟磷灰石(化学式为Ca5P3FO12)制备磷酸二氢钾的工艺流程如下图所示(部分流程步骤已省略):
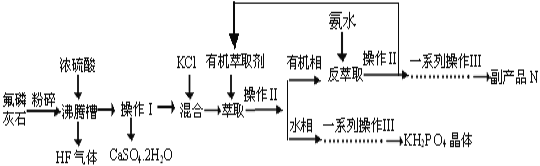
已知萃取的主要反应原理:KCl+H3PO4![]() KH2PO4+HCl;其中,反应产生的HCl易溶于有机萃取剂。
KH2PO4+HCl;其中,反应产生的HCl易溶于有机萃取剂。
请回答下列问题:
(1)流程中将氟磷灰石粉碎的目的是__________________________________。
(2)不能使用二氧化硅陶瓷材质的沸腾槽的主要原因是___________________(用化学方程式表示)。
(3)副产品N的化学式是____________;在得到KH2PO4晶体的一系列操作Ⅲ,其主要包括______________________________、过滤、洗涤、干燥等。
(4)若用1000kg质量分数为50.4%的氟磷灰石(化学式为Ca5P3FO12)来制取磷酸二氢钾晶体,其产率为80%,则理论上可生产KH2PO4的质量为_______kg。
(5)电解法制备KH2PO4的装置如图所示.该电解装置中,a 区属于_______区(填“阳极”或“阴极”),阴极区的电极反应式是______________________________________。

(6)工业上还可以用氟磷灰石与焦炭、石英砂混合,在电炉中加热到1500℃生成白磷,同时逸出SiF4和CO,该反应的化学方程式为________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用I2O5可消除CO污染,反应为I2O5(s)+5CO(g)![]() 5CO2(g)+I2(s)。不同温度下,向装有足量的I2O5固体的2L恒容密闭容器中通入2mol CO,测得CO2 的体积分数ψ(CO2)随时间t变化曲线如右图,下列说法正确的是
5CO2(g)+I2(s)。不同温度下,向装有足量的I2O5固体的2L恒容密闭容器中通入2mol CO,测得CO2 的体积分数ψ(CO2)随时间t变化曲线如右图,下列说法正确的是

A. b点时,CO的转化率为20%
B. 容器内的压强保持恒定,表明反应达到平衡状态
C. b点和d点的化学平衡常数:Kb>Kd
D. 0到0.5min反应速率v(CO)=0.3mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭体系中发生下列反应:N2(g)+3H2(g)![]() 2NH3(g)△H<0,如图所示是某一时间段中反应速率与反应进程的曲线关系图,回答下列问题:
2NH3(g)△H<0,如图所示是某一时间段中反应速率与反应进程的曲线关系图,回答下列问题:

(1)处于平衡状态的时间段是__.
(2)t1、t3、t4时刻体系中分别改变的是什么条件?
t1:__,t3:__,t4:__.
(3)下列各时间段时,氨的体积分数最高的是______。
A.t2~t3 B.t3~t4 C.t4~t5 D.t5~t6.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A~G为中学化学中常见的物质,B、E、F为单质,在常温下B是一种有色气体,G为黑色固体。它们的相互转化如图所示,部分生成物未列出。试回答下列问题:
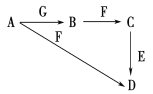
(1)F的一种氧化物常用作红色油漆和涂料,这种氧化物的俗称为________。
(2)E在电气、电子工业中应用最广,也是人类发现最早的金属之一。写出E与C反应的离子方程式________,利用电解法可提纯E物质,在该电解反应中阳极物质是________,阴极物质是________,电解质溶液是__。
(3)写出下列物质的化学式:A________、G________。
(4)将B与SO2等体积混合后,通入品红溶液中,观察到的现象是__________,涉及的离子方程式为______,工业上获得B的重要途径是________(用化学方程式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能证明铝的金属性比镁弱的实验事实是
A.Al(OH)3能溶于NaOH溶液,而Mg(OH)2不能
B.铝的原子半径比镁小
C.镁与浓硫酸反应,铝与冷的浓硫酸不反应
D.铝的金属光泽不如镁显著
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组用0.50 mol·L-1 NaOH溶液和0.50 mol·L-1 硫酸溶液进行中和热的测定。

(1)测定稀硫酸和稀氢氧化钠中和热的实验装置如图所示,其中仪器a的名称为_____________;
(2)写出该反应中和热的热化学方程式(中和热为57.3 kJ·mol-1)______________;
(3)取50 mL NaOH溶液和30 mL硫酸溶液进行实验,实验数据如下表。
① 请填写下表中的空白:
温度 实验次数 | 起始温度t1/℃ | 终止温度 t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
H2SO4 | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 30.1 | __________ |
2 | 27.0 | 27.4 | 26.2 | 31.2 | |
3 | 25.9 | 25.9 | 25.9 | 29.8 | |
4 | 26.4 | 26.2 | 26.3 | 30.4 | |
② 近似认为0.50 mol·L-1 NaOH溶液和0.50 mol·L-1 硫酸溶液的密度都是1 g·cm-3,中和后生成溶液的比热容c=4.18kJ·(kg·℃)-1。则中和热ΔH=________________________(取小数点后一位);
③ 上述实验数据结果与57.3 kJ·mol-1有偏差, 产生偏差的原因不可能是(填字母)________。
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】球墨铸铁中含有一种铁碳化合物X。实验小组为测定化合物X的组成设计实验如下:
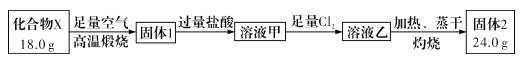
下列说法不正确的是
A. 固体2是氧化铁
B. X的化学式可以表示为Fe3C2
C. 将溶液甲在空气中加热、蒸干、灼烧也可得到24.0g固体
D. X与足量的热浓硝酸反应有NO2和CO2生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学利用氧化还原反应:2KMnO4+10FeSO4+8H2SO4=2MnSO4+5Fe2(SO4)3+K2SO4 +8H2O设计如下原电池,盐桥中装有饱和KCl溶液。下列说法正确的是
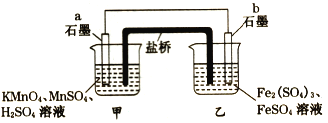
A. b电极上发生还原反应
B. 外电路电子的流向是从a到b
C. 电池工作时,盐桥中的SO42-移向甲烧杯
D. a电极上发生的反应为:MnO4-+8H++5e- = Mn2++4H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com